题目内容
下列离子方程式正确的是( )
| A、澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | ||||
| B、钠与水的反应Na+2H2O═Na++2OH-+H2↑ | ||||
| C、硫酸氢钠溶液与少量氢氧化钡溶液混合:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | ||||
D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O
|
考点:离子方程式的书写
专题:离子反应专题
分析:A、澄清的石灰水,应写成离子符号;
B、从离子方程式遵循电荷守恒的角度分析;
C、少的物质要符合化学式的组成比;
D、制备Fe(OH)3胶体不要加热,无沉淀符号.
B、从离子方程式遵循电荷守恒的角度分析;
C、少的物质要符合化学式的组成比;
D、制备Fe(OH)3胶体不要加热,无沉淀符号.
解答:
解:A、澄清的石灰水,应写成离子符号,正确的离子方程式为OH-+H+═H2O,故A错误;
B、电子得失不守恒,正确的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C、少的物质要符合化学式的组成比,离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C正确;
D、制备Fe(OH)3胶体不要加热,无沉淀符号,正确的离子方程式为Fe3++3H2O
Fe(OH)3(胶体)+3H+,故D错误;
故选C.
B、电子得失不守恒,正确的离子方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C、少的物质要符合化学式的组成比,离子方程式为2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故C正确;
D、制备Fe(OH)3胶体不要加热,无沉淀符号,正确的离子方程式为Fe3++3H2O
| ||
故选C.
点评:本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验操作中,错误的是( )
| A、分液时,分液漏斗中下层液体从下口放出后,换个洁净的烧杯,将上层液体从上口放入烧杯中 |
| B、蒸馏时,应使温度计水银球位于蒸馏烧瓶支管口处 |
| C、用酒精萃取溴水溶液中的溴 |
| D、称量时,将称量物体放在称量纸或烧杯中,置于托盘天平的左盘,砝码放在托盘天平的右盘 |
下列各组离子中,因发生氧化还原反应而不能大量共存的是( )
| A、K+、H+、I-、MnO4- |
| B、Fe3+、Fe2+、SO42-、NO3- |
| C、Al3+、Na+、SO42-、CO32- |
| D、Fe3+、H+、SO42-、ClO- |
已知:
①2H2(g)+O2(g)→2H2O(g)+483.6kJ;
②H2(g)+S(g)→H2S(g)+20.1kJ.
下列判断一定正确的是( )
①2H2(g)+O2(g)→2H2O(g)+483.6kJ;
②H2(g)+S(g)→H2S(g)+20.1kJ.
下列判断一定正确的是( )
| A、1mol氢气完全燃烧吸热246.8 kJ |
| B、1mol水蒸气和1mol硫化氢的能量相差221.7 kJ |
| C、由①②知,水的热稳定性小于硫化氢 |
| D、若反应②中改用固态硫,放热将小于20.1 kJ |
“钴酞菁(分子直径1.3×10-9m)”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似,我国科学家在世界上第一次为“钴酞菁”分子恢复了磁性.下列关于“钴酞菁”的说法正确的是( )
| A、在水中形成的分散系属于悬浊液 |
| B、分子直径比Na+小 |
| C、“钴酞菁”分子不能透过滤纸 |
| D、在水中形成的分散系具有丁达尔效应 |
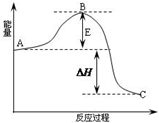 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ?mol-1.请回答下列问题: