题目内容
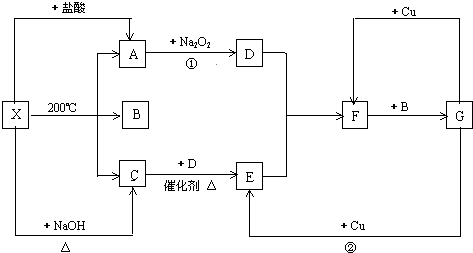
17.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)最高价氧化物的水化物中,酸性最强的化合物的化学式:HClO4,碱性最强的化合物的电子式:
 .
.(3)最高价氧化物是两性氧化物的元素是Al.
(4)用电子式表示元素④与⑥形成化合物的过程:
 .
.(5)①与⑦形成的化合物的电子式:
 ,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
分析 由元素在周期表中的相对位置可知:①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K,
(1)稀有气体化学性质稳定;
(2)上述元素中高氯酸为含氧酸中酸性最强的酸,KOH的碱性最强;
(3)氧化物中氧化铝为两性氧化物;
(4)④与⑥形成化合物为Na2S;
(5)①与⑦形成的化合物为CCl4.
解答 解:由元素在周期表中的相对位置可知:①是C,②是N,③是O,④是Na,⑤是Al,⑥是S,⑦是Cl,⑧是Ar,⑨是K,
(1)这些元素中,化学性质最不活泼的是Ar,故答案为:Ar;
(2)上述元素中高氯酸为含氧酸中酸性最强的酸,其化学式为HClO4,KOH的碱性最强,其电子式为 ,
,
故答案为:HClO4; ;
;
(3)氧化物中氧化铝为两性氧化物,则最高价氧化物是两性氧化物的元素是Al,故答案为:Al;
(4)④与⑥形成化合物为Na2S,电子式表示化合物的形成过程为
故答案为: ;
;
(5)①与⑦形成的化合物为CCl4,为共价化合物,各原子满足8电子稳定结构,电子式为
故答案为:
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意化学用语的使用,题目难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
7.在硫酸铝、硫酸钾和明矾的混合溶液中,SO42-的浓度为0.4mol/L,当加入等体积0.3mol/L KOH溶液时,生成的沉淀量最多.则反应后溶液中K+的浓度约为( )
| A. | 0.25mol/L | B. | 0.44mol/L | C. | 0.5mol/L | D. | 0.8mol/L |
8.下列物质中不属于有机物的是( )
| A. | 碳酸钠(Na2CO3) | B. | 醋酸(CH3COOH) | C. | 乙炔 | D. | 四氯化碳(CCl4) |
5.取四张湿润的蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加69%的硝酸、98.3%的硫酸、新制氯水、浓氨水,四张试纸最后呈现的颜色是( )
| A. | 白、红、白、蓝 | B. | 白、白、白、蓝 | C. | 白、黑、白、蓝 | D. | 红、黑、红、蓝 |
2.合成药物异搏定路线中某一步骤如下:
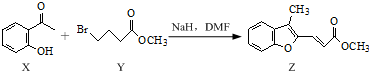
下列说法正确的是( )
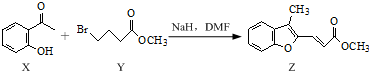
下列说法正确的是( )
| A. | 物质X在空气中不易被氧化 | |
| B. | 物质Y中只含1个手性碳原子 | |
| C. | 物质Z中所有碳原子可能在同一平面内 | |
| D. | 等物质的量的X、Y分别与NaOH反应,最多消耗NaOH的物质的量之比为1:2 |
9.由于地球引力的存在,人在地球上生活而不能自动脱离地球.同理,原子之间能自动结合是因为它们之间存在着强烈的相互作用--化学键,由于有化学键才使得100多种元素构成了世界万物.下列有关化学键的叙述,正确的是( )
| A. | 离子化合物中一定含有离子键,可能含共价键,共价化合物中只含共价键绝不含有离子键 | |
| B. | 单质分子中均存在化学键,且只含有共价键,不可能含有离子键 | |
| C. | 共价化合物中可能含非极性共价键,离子化物中不可能含非极性共价键 | |
| D. | 共价化合物中可能含离子键,离子化合物中只含离子键 |
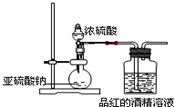 为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)
为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)