题目内容
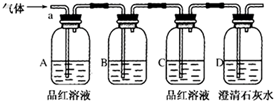
5.取四张湿润的蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加69%的硝酸、98.3%的硫酸、新制氯水、浓氨水,四张试纸最后呈现的颜色是( )| A. | 白、红、白、蓝 | B. | 白、白、白、蓝 | C. | 白、黑、白、蓝 | D. | 红、黑、红、蓝 |
分析 酸遇蓝色的石蕊变红,但硝酸、氯水都具有漂白性,浓硫酸具有脱水性;碱遇蓝色石蕊还是蓝色,以此来解答.
解答 解:取四张湿润的蓝色石蕊试纸放在玻璃片上,然后按顺序分别滴加69%的硝酸、98.3%的硫酸、新制氯水、浓氨水,
因硝酸具有强氧化性,能使试纸褪色,则滴加69%的硝酸,先变红后褪色,最后为白色;
因98.3%的硫酸为浓硫酸,具有脱水性,则能使蓝色石蕊试纸最后变为黑色;
因氯水中含有盐酸和次氯酸,新制氯水具有漂白性,则在试纸上滴加氯水,先变红后褪色,最后为白色;
浓氨水溶液显碱性,遇蓝色石蕊还是蓝色,
故选C.
点评 本题考查硝酸、硫酸、氯水、氨水的性质,明确酸碱指示剂的变色、具有漂白性的物质等即可解答,难度不大,硝酸的漂白是学生解答中的易错点.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
14.下列实验操作和结论错误的是( )
| A. | 用新制Cu(OH)2可鉴别麦芽糖和蔗糖 | |
| B. | 用银镜反应可证明淀粉是否转化为葡萄糖,但不能证明是否完全转化 | |
| C. | 浓H2SO4可使蔗糖脱水变黑,证明蔗糖含C,H,O三种元素 | |
| D. | 蔗糖溶液中滴加几滴稀H2SO4后,水溶加热几分钟,加入到银氨溶液中,不能发生银镜反应,证明蔗糖不水解 |
13.下表为元素周期表的一部分:
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的原子结构示意图 .
.
(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式: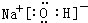 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
(1)请画出元素⑦的原子结构示意图
 .
.(2)写出元素⑤在周期表中的位置第三周期第 IVA族.
(3)②、③、⑥的离子半径由大到小的顺序为S2->O2->Na+.
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是HClO4>H2SO4>H2SiO3.
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:
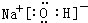 .该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
.该化合物与④的最高价氧化物反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O.
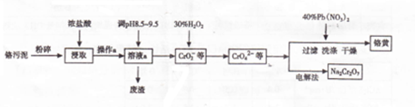
20.硫酸亚铁铵又称莫尔盐,是浅绿色晶体.它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂.某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度.
已知:
①
②莫尔盐在乙醇溶剂中难溶.
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出.
(2)步骤3中包含的实验操作名称加热浓缩、冷却结晶.
(3)产品莫尔盐最后用b洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL -1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+已被空气部分氧化,验证推测的方法为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化.
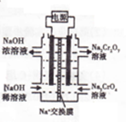
(丙)方案三:(通过NH 4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.
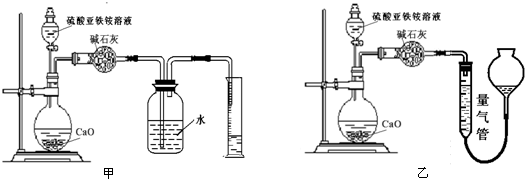
(2)①装置乙(填“甲”或“乙”)较为合理,判断理由是甲装置会出现倒吸.量气管中最佳试剂是 (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为$\frac{392V×25}{44.8m}$×100%.
已知:
①
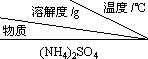 | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.3 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4•7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4•FeSO4•6H2O | 18.1 | 21.2 | 24.5 | 27.9 | 31.3 | 38.5 |
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是防止Fe2+被氧化,同时热过滤可防止硫酸亚铁以晶体形式析出.
(2)步骤3中包含的实验操作名称加热浓缩、冷却结晶.
(3)产品莫尔盐最后用b洗涤(填字母编号).
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4FeSO46H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00mL硫酸亚铁铵溶液用0.1000molL -1的酸性KMnO4溶液分三次进行滴定.
(乙)方案二:取20.00mL硫酸亚铁铵溶液进行如下实验.

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为Fe2+已被空气部分氧化,验证推测的方法为:取少量硫酸亚铁铵溶液,加入少量KSCN溶液,若溶液变为血红色,说明Fe2+已被空气部分氧化.
(丙)方案三:(通过NH 4+测定)实验设计图如下所示.取20.00mL硫酸亚铁铵溶液进行该实验.

(2)①装置乙(填“甲”或“乙”)较为合理,判断理由是甲装置会出现倒吸.量气管中最佳试剂是 (填字母编号.如选“乙”则填此空,如选“甲”此空可不填).
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为$\frac{392V×25}{44.8m}$×100%.
17.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)这些元素中,化学性质最不活泼的是Ar(填元素符号,下同).
(2)最高价氧化物的水化物中,酸性最强的化合物的化学式:HClO4,碱性最强的化合物的电子式: .
.
(3)最高价氧化物是两性氧化物的元素是Al.
(4)用电子式表示元素④与⑥形成化合物的过程: .
.
(5)①与⑦形成的化合物的电子式: ,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)最高价氧化物的水化物中,酸性最强的化合物的化学式:HClO4,碱性最强的化合物的电子式:
 .
.(3)最高价氧化物是两性氧化物的元素是Al.
(4)用电子式表示元素④与⑥形成化合物的过程:
 .
.(5)①与⑦形成的化合物的电子式:
 ,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
,该化合物是由极性(填“极性”或“非极性”)共价键形成的.
14.“司乐平”是治疗高血压的一种临床药物,其有效成分M的结构简式如下图所示.
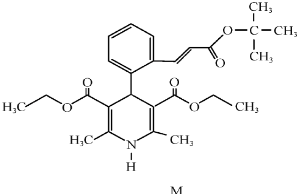
下列关于M的说法正确的是( )

下列关于M的说法正确的是( )
| A. | 属于芳香族化合物 | B. | 遇FeCl3溶液显紫色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 1molM完全水解生成2mol醇 |
 ;
; .
.