题目内容
2.磷酸亚铁[Fe3(PO4)2•8H2O]是一种白蓝色单斜晶体,溶于稀强酸溶液,不溶于水、醋酸、醇.主要用于制造磷酸铁锂电池材料.实验室制备磷酸亚铁的装置示意图如下: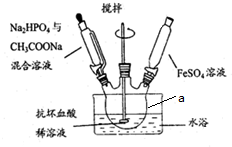
主要反应为:3FeSO4+2Na2HPO4+2CH3COONa+8H2O=Fe3(PO4)2•8H2O↓+3Na2SO4+2CH3COOH
实验步骤:①在仪器a中先加入抗坏血酸(C6H8O6)稀溶液作底液;②向烧瓶中滴入足量Na2HPO4与CH3COONa混合溶液至pH=4;③再滴入含15.2gFeSO4的溶液,最终维持pH=6,静置;④进行操作b,干燥得到磷酸亚铁粗产品12.8g.
回答下列问题:
(1)仪器a的名称是三颈烧瓶.
(2)实验中由原料配制溶液时,蒸馏水事先要进行的处理方法是煮沸除去溶液中的溶解的氧气
(3)实验不是将三种溶液直接混合的原因是避免生成Fe(OH)2沉淀,制备时需不断搅拌,其目的是使反应物充分接触,避免生成Fe(OH)2沉淀
(4)步骤④进行的操作b是过滤、洗涤
(5)检验磷酸亚铁粗产品中是否有Fe(OH)3杂质的方法是取少量固体溶于适量盐酸,然后滴入KSCN溶液,溶液变红色,说明含有Fe(OH)3杂质,否则不含
(6)本次实验的磷酸亚铁产率是76.5%(结果保留三位有效数字)
分析 (1)仪器a为三颈烧瓶;
(2)配制溶液时加热抗坏血酸,防止Fe2+离子被氧化,蒸馏水事先要煮沸除去溶液中的溶解的氧气;
(2)①分别加入药品,混合溶液至pH=4时,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;
②制备时需不断搅拌,使反应物充分接触,也会防止生成Fe(OH)2沉淀;
(3)生成的Fe3(PO4)2•8H2O 固体混有杂质SO42-离子,通过检验SO42-,判断沉淀洗涤干净与否;
(4)步骤是分离不溶的固体与液体得到磷酸亚铁粗产品,需要采取过滤、洗涤等;
(5)用盐酸溶解,再用KSCN溶液检验Fe3+;
(6)根据Fe原子守恒计算Fe3(PO4)2•8H2O的理论产量,进而计算产率.
解答 解:(1)由仪器结构特征,可知仪器a为三颈烧瓶,
故答案为:三颈烧瓶;
(2)Fe2+具有强还原性,配制溶液时加热抗坏血酸,防止Fe2+离子被氧化,蒸馏水事先要煮沸、冷却,可以除去溶液中的溶解的氧气,避免氧化Fe2+;
故答案为:煮沸除去溶液中的溶解的氧气;
(3)Na2HPO4与CH3COONa混合溶液呈碱性,直接混合容易产生成Fe(OH)2沉淀,实验时三种溶液分别加入,混合溶液至pH=4时,再加入FeSO4溶液,防止生成Fe(OH)2沉淀;
制备时需不断搅拌,使反应物充分接触,也会防止生成Fe(OH)2沉淀;
故答案为:避免生成Fe(OH)2沉淀;使反应物充分接触,避免生成Fe(OH)2沉淀;
(4)步骤是分离不溶的固体与液体得到磷酸亚铁粗产品,需要采取过滤、洗涤等,
故答案为:过滤、洗涤;
(5)检验磷酸亚铁粗产品中是否有Fe(OH)3杂质的方法是:取少量固体溶于适量盐酸,然后滴入KSCN溶液,溶液变红色,说明含有Fe(OH)3杂质,否则不含,
故答案为:取少量固体溶于适量盐酸,然后滴入KSCN溶液,溶液变红色,说明含有Fe(OH)3杂质,否则不含;
(6)15.2gFeSO4的物质的量为$\frac{15.2g}{152g/mol}$=0.1mol,根据Fe元素守恒,理论上得到Fe3(PO4)2•8H2O的质量为0.1mol×$\frac{1}{3}$×502g/mol=16.73g,磷酸亚铁产率是$\frac{12.8g}{16.73g}$×100%=76.5%,
故答案为:76.5%.
点评 本题考查物质制备实验方案,涉及对仪器识别、物质的分离提纯、对操作的分析评价、实验方案设计、产率计算等,较好的考查学生信息获取与知识迁移运用能力,题目难度中等.

 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案| A. | 氨水中铵根离子和氢氧化钠溶液中钠离子浓度相等 | |
| B. | 温度下降10℃,两溶液的pH均不变 | |
| C. | 氨水和氢氧化钠溶液的浓度相等 | |
| D. | 分别与等浓度的盐酸反应,氨水消耗盐酸的体积与氢氧化钠消耗盐酸的体积相等 |
| A. | HBr、CO2、H2O、CS2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | NaCl、HCl、H2O、NaOH | D. | Na2O2、H2O2、H2O、O3 |