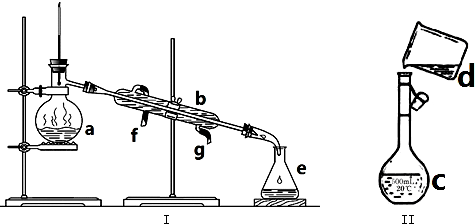
��Ŀ����
10���ȼ��仯����㷺��������Ȼ���У��ش��������⣺��1���ڻ�̬��ԭ���У��Ų����ӵ�ԭ�ӹ����Ϊ9������۵��Ӳ��д���3�������෴�ĵ��ӣ�
��2�����Ȼ�̼��ˮ�����ܷ����ֲ㣬���Ȼ��������Ȼ�̼���ӽṹ���ƣ�����ˮ������ˮ�ⷴӦ�����¶������ʲ�ͬ��ԭ���ǹ�ԭ����3d�չ������̼ԭ��û��d�չ������Ϊû��2d����������ܽ�����ԭ�ӵŶԵ��ӣ������Ĺ軯̼��ˮ������Ȼ�̼����ˮ�⣮
��3������ʱ�Ȼ������ɿɻӷ��Ķ�����Al2Cl6��������д��ڵĻ�ѧ���������й��ۼ�����λ����Alԭ�ӵ��ӻ����������sp3�������¶�ʱ�������������AlCl3����BF3�ṹ���ƣ�������ӿռ乹��Ϊƽ�������Σ�
��4������±���NaF��CsCl��HF��HCl�����۵�Ӹߵ��͵�˳��ΪNaF��CsCl��HF��HCl��
��5��CuCl�л�̬Cu+�ļ۲�����Ų�ʽΪ3d10���侧������п�����ƣ���������ԭ�ӷֱ�λ�����ĺͶ��㣬��λ�ھ����ڲ���Cuԭ����4�����侧������a=x nm����ʽ��ʾCuCl������ܶ�$\frac{398}{{N}_{A}����x��1{0}^{-7}��^{3}}$g•cm-3�����ؼ�����������
���� ��l����̬��ԭ��ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p5��s�ܼ���1�������p�ܼ���3���������������3�������෴�ĵ��ӣ�
��2��һ�����ʵķ�����ˮ���Ӽ��������Խ��Խ������Ӧ��Siԭ�ӵİ뾶����3d�չ��������ˮ�γ���λ������ǿ����ˮ���Ӽ����������
��3��Al2Cl6������������������غϣ����ڷǼ��Է��ӣ�ÿ����ԭ�Ӻ��ĸ���ԭ���γɹ��ۼ���������λ��������ȡsp3�ӻ��������Ȼ����ṹ�жϿռ�ṹ��ԭ���ӻ����ͣ�
��4�����Ӿ���ľ����ܴ�Сȡ�������Ӱ뾶�ĵ�ɵ����أ����Ӱ뾶ԽС�����Խ�࣬������Խ�����Ӿ�����۵�Խ�ߣ�HF����������е�ϸߣ�
��5��CuΪ29��Ԫ�أ����ڵ�4���ڵڢ�B��Ԫ�أ�Cu+�ļ۲�����Ų�ʽΪ3d10�����ݾ����ܶ�$��=\frac{m}{V}$���㣮
��� �⣺��1����̬��ԭ��ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p5��ÿһ��s�ܼ���1�������p�ܼ���3���������ԭ��ԭ�ӹ����Ϊ9����������3�������෴�ĵ��ӣ�
�ʴ�Ϊ��9��3��
��2����ԭ����3d�չ������̼ԭ��û��2d�չ��Ҳ��û��d�չ�������ܽ�����ԭ�ӵŶԵ��ӣ��������γ���λ������ˮ���Ӽ��������С�����ܷ�Ӧ�������Ĺ軯̼��ˮ������Ȼ�̼����ˮ�⣻
�ʴ�Ϊ����ԭ����3d�չ������̼ԭ��û��d�չ������Ϊû��2d����������ܽ�����ԭ�ӵŶԵ��ӣ������Ĺ軯̼��ˮ������Ȼ�̼����ˮ�⣻
��3����ԭ�Ӻ���ԭ��֮���γɹ��ۼ������γ�һ����λ������ṹΪ ���Ȼ�����ÿ����ԭ�Ӻ���3�����ۼ����Ҳ����µ��Ӷԣ�Ϊƽ�������νṹ����˫����Al2Cl6��Alԭ�ӵĹ���ӻ�����sp3��
���Ȼ�����ÿ����ԭ�Ӻ���3�����ۼ����Ҳ����µ��Ӷԣ�Ϊƽ�������νṹ����˫����Al2Cl6��Alԭ�ӵĹ���ӻ�����sp3��
�ʴ�Ϊ�����ۼ�����λ����sp3��ƽ�������Σ�
��4���ṹ���Ƶ����Ӿ��壬���Ӱ뾶ԽС��������Խ���۵�Խ�ߣ�ΪNaF��CsCl��HF����������е����HCl�ģ�ΪHF��HCl�����Ӿ�����۵���ڷ��Ӿ�����۵㣬��NaF��CsCl��HF��HCl��
�ʴ�Ϊ��NaF��CsCl��HF��HCl��
��5��CuΪ29��Ԫ�أ����ڵ�4���ڵڢ�B��Ԫ�أ�Cu�ļ۲�����Ų�ʽΪ3d104s1��Cu+�ļ۲�����Ų�ʽΪ3d10��CuCl��������ԭ�ӷֱ�λ�����ĺͶ��㣬��Clԭ�ӵ���ĿΪ$6��\frac{1}{2}+8��\frac{1}{8}=4$��CuCl��Cu��Clԭ����Ŀ֮��Ϊ1��1����λ�ھ����ڲ���Cuԭ����4������������a=x nm=x��10-7cm���������V=a3cm3����������m=$\frac{64��4+35.5��4}{{N}_{A}}$g����CuCl������ܶ�$��=\frac{m}{V}$=$\frac{398}{{N}_{A}����x��1{0}^{-7}��^{3}}$��
�ʴ�Ϊ��$\frac{398}{{N}_{A}����x��1{0}^{-7}��^{3}}$��
���� �����ۺϿ������ʵĽṹ�����ʣ�������ѧ���ķ��������Ŀ��飬ע������ӻ������Լ��۲���������жϣ��Ѷ��еȣ�

| A�� | ��������ͭ��ʹп��ϡ����ķ�Ӧ���ʼӿ죬˵��Cu2+���д����� | |
| B�� | ����HA��HB�ĵ��볣������Դ�С����ֱ���ж�������Һ������ǿ�� | |
| C�� | ������2S2O��g���T3S��s��+SO2��g�����Է����У����ƶϸ÷�ӦΪ���ȷ�Ӧ | |
| D�� | ��Ũ�����Ũ�����Ϻ�����������Ƭ����Ƭ���ۻ���Ч��һ������� |
| A�� | ��ͬ�¶��£��������Ȼ�������ֱ������ͬ����Ģ�����ˮ ��0.1 mol/L�����0.1 mol/L�Ȼ�þ��Һ ��0.1 mol/L��������Һ�У�Ag+Ũ�ȣ��٣���=�ڣ��� | |
| B�� | �ں���BaSO4��������Һ�м���Na2SO4���壬c��Ba2+������ | |
| C�� | ��Mg��OH��2����Һ�еμ�FeCl3��Һ��������Ϊ���ɫ��˵���ܽ��Mg��OH��2��Fe��OH��3 | |
| D�� | ��֪I3-?I2+I-����ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
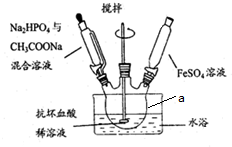
��1���ڸó�������ˮ�з���ϸ�����ɻ�ý���ͭ����ԭ����Fe+Cu2+=Fe2++Cu�������ӷ���ʽ��ʾ����
��2��ͭ������ˮ�л����ܴ������ڵ���������C��D��
A��CO32- B��OH- C��Cl- D��SO42-
��3����ⲿ�ŶԸó����ŷ�ˮ�ļ���������£�
| ���� | ������Ŀ | �������ݣ�mg/mL�� |
| 1 | ͭ���Ӻ��� | 4.224 |
| 2 | 4.225 | |
| 3 | 4.223 | |
| 4 | 2.005 |
����Ҫʹ�ó���ˮ�ŷŴ�꣬Ӧ���Ƶ���СpH=9.2������֪25��ʱ��Ksp[Cu��OH��2]=2.2��10-20��
��4���ó���ˮ���ԡ����Ϊ������������ͼ���£�

�ٸ�Ũ�ȵĺ�ͭ��ˮ������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�������Եõ����Ƚϸߵ�ͭ�ξ��壮
���ýϸ�Ũ�Ⱥ�ͭ��ˮ�����ͭ���������ĵ缫��Ӧʽ��Cu2++2e-=Cu�����5L�ó��ŷŵĺ�ͭ��ˮ�������Ͽ��Եõ�ͭ21.12g��
| A�� | ���������������������ֱ���ȫȼ�գ����߷ų��������� | |
| B�� | ��֪C��s��+$\frac{ax}{0.02}$O2��g��=CO��g���ķ�Ӧ��Ϊ110.5kJ/mol��˵��̼��ȼ����Ϊ110.5kJ | |
| C�� | ��֪��ӦX+Y=M+NΪ���ȷ�Ӧ���ʲ��ؼ��ȾͿɷ��� | |
| D�� | ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ•mol-1��������0.5 molH2SO4��Ũ��Һ�뺬1 molNaOH����Һ��ϣ��ų�����������57.3KJ |
| A�� | b��c | B�� | a+b��2c | C�� | a+b��c | D�� | a+b��2c |
| W | X | Y |
| Z |
| A�� | ����Ԫ�ص�ԭ�Ӱ뾶��r��Z����r��X����r��Y����r��W�� | |
| B�� | ����Ԫ���γɵĵ��������6�� | |
| C�� | X��Y�γɵ���̬�����ﳬ������ | |
| D�� | ����Ԫ���У�Z������������Ӧ��ˮ����������ǿ |