题目内容
14.某非金属单质A经如图所示的过程转化为含氧酸D,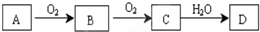
已知D为强酸,请回答下列问题:
(1)若A常温下为淡黄色固体,B是有刺激性气味的无色气体.
①氯水和B皆可作漂白剂.若同时使用于漂白一种物质时,其漂白效果是减弱(填“增强”“减弱”“不变”),用化学方程式解释上述原因SO2+Cl2+2H2O=2HCl+H2SO4;
②D的浓溶液与铜发生反应的方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)若A在常温下为气体,C是红棕色气体.
①A转化为B的化学方程式是:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,
②D的稀溶液在常温下可与铜反应并生成B气体,请写出该反应的离子方程式:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
分析 题中能发生连续氧化的非金属单质A,对应的D为强酸,则对应的反应有硫和氮元素及其化合物的转化:
(1)A在常温下为淡黄色固体,是非金属单质判断A为S,B是有刺激性气味的无色气体转化关系可知为二氧化硫,则A为S元素,B为SO2,C为SO3,D为H2SO4,
①氯气具有强氧化性,二氧化硫具有还原性,在水溶液中发生氧化还原反应生成硫酸和盐酸;
②D为H2SO4,D的浓溶液与铜反应生成硫酸铜、二氧化硫和水;
(2)A在空气中的主要成分,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3,
①A应为N2,B为NO,A可与O2反应生成NO;
②D为HNO3,稀溶液具有强氧化性,可与Cu发生氧化还原反应生成硝酸铜和NO;
结合物质的性质解答该题.
解答 解:题中能发生连续氧化,对应的反应有硫和氮元素及其化合物的转化:
(1)A在常温下为淡黄色固体,是非金属单质判断A为S,B是有刺激性气味的无色气体转化关系可知为二氧化硫,则A为S元素,B为SO2,C为SO3,D为H2SO4,
①氯水和B为SO2皆可作漂白剂,若同时使用于漂白一种物质时,因为氯气具有强氧化性,二氧化硫具有还原性,在水溶液中发生氧化还原反应生成硫酸和盐酸,漂白效果减弱,反应的化学方程式为:SO2+Cl2+2H2O=2HCl+H2SO4,
故答案为:减弱; SO2+Cl2+2H2O=2HCl+H2SO4;
②D为H2SO4,D的浓溶液与铜反应的化学反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)A在空气中的主要成分,C是红棕色的气体,则A应为N2,B为NO,C为NO2,D为HNO3,
①A应为N2,B为NO,A可与O2反应生成NO,反应的化学方程式为N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO,
故答案为:N2+O2$\frac{\underline{\;放电\;}}{\;}$2NO;
②D为HNO3,稀溶液具有强氧化性,可与Cu发生氧化还原反应生成硝酸铜和NO,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O.
点评 本题考查无机物的推断,题目难度中等,本题注意根据物质的颜色以及连续发生氧化反应的特征为突破口进行推断.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案(1)在该厂所排污水中放置细铁网可获得金属铜,其原理是Fe+Cu2+=Fe2++Cu(用离子方程式表示).
(2)铜超标污水中还可能大量存在的阴离子是C、D.
A.CO32- B.OH- C.Cl- D.SO42-
(3)检测部门对该厂所排废水的检测数据如下:
| 次数 | 测量项目 | 测量数据(mg/mL) |
| 1 | 铜离子含量 | 4.224 |
| 2 | 4.225 | |
| 3 | 4.223 | |
| 4 | 2.005 |
②若要使该厂废水排放达标,应控制的最小pH=9.2.(已知25℃时,Ksp[Cu(OH)2]=2.2×10-20)
(4)该厂废水可以“变废为宝”,其流程图如下:

①高浓度的含铜废水经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可以得到纯度较高的铜盐晶体.
②用较高浓度含铜废水点解制铜,其阴极的电极反应式是Cu2++2e-=Cu;电解5L该厂排放的含铜废水,理论上可以得到铜21.12g.
| A. | b>c | B. | a+b>2c | C. | a+b<c | D. | a+b<2c |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 | |
| 第2周期 | ① | ② | ③ | |||||
| 第3周期 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 第4周期 | ⑨ | ⑩ |
(2)在①~⑩元素中,金属性最强的元素是K(填元素符号),气态氢化物能与其最高价氧化物对应的水化物发生反应生成盐的元素是N(填元素符号).
(3)元素⑥与元素⑦相比,⑦的非金属性较强,下列表述中能证明这一事实的是bd.
a.常温下⑥的单质和⑦的单质状态不同
b.⑦的氢化物比⑥的氢化物稳定
c.一定条件下⑥和⑦的单质都能与氢氧化钠溶液反应
d.一定条件下⑥和⑦的单质与Fe反应的产物不同
(4)⑤的单质可以与⑨的最高价氧化物的水化物的溶液反应,若将该反应设计成原电池,其负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O.
| A. | 利用H++OH-═H2O來测量某氢氧化钠溶液的浓度时:甲基橙--橙色 | |
| B. | 利用“2Fe3++2I-═I2+2Fe2+,用NaI溶液测量Fe(NO3)3样品中Fe(NO3)3百分含量:淀粉--蓝色 | |
| C. | 利用“Ag++SCN-=AgSCN↓原理,可用标准KSCN溶液含量AgNO3溶液浓度:Fe(NO3)3--血 红色 | |
| D. | 用标准酸性KMnO4溶液滴定NaHSO3溶液以测量其浓度:KMnO4--紫红色 |
| A. | 日常生活中的陶瓷、水泥、玻璃等是使用量最大的无机非金属材料 | |
| B. | 制饭勺、高压锅等的不锈钢是合金.合金有许多优良的性能,如熔点比成分金属高 | |
| C. | 防止或减少雾霾形成的措施之一是减少煤的燃烧和机动车的使用 | |
| D. | 食品干燥剂应无毒、无味、无腐蚀性及环境友好,硅胶可用作食品干燥剂 |
 CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.
CH3COOH为常见的弱酸,在工业生产和生活中有广泛的应用.