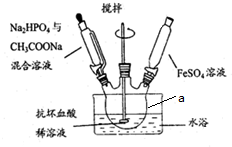
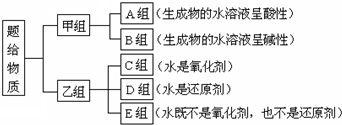
��Ŀ����
12�����ᡢ�������������ѧ�γ����ġ������ᡱ���־��������������Ӧ��������ش��������⣺��1��ϡ�����Cu��Ӧ������ϡ�����м���H2O2����������������������ʱ��ԭ����Ϊˮ�������ʹͭ˳���ܽ⣮�÷�Ӧ�Ļ�ѧ����ʽΪ��Cu+H2O2+2HCl�T2H2O+CuCl2��
��2����һ�������10mol•L-1��Ũ�����м������ͭƬ������ʹ֮��Ӧ������ԭ������Ϊ0.9mol����Ũ�����ʵ��������ڣ�����ڡ��������ڡ���С�ڡ���180mL����ʹʣ���ͭƬ�����ܽ⣬�������м�����������Һ����KNO3��Һ������÷�Ӧ�����ӷ���ʽΪ3Cu+2NO3-+8H+�T3Cu2++2NO��+4H2O��
��3����Ѹ�ٳ�ȥ�����ײ���ˮ�����ֲ�����������õķ�����C
A��Ũ���� B��ϡ���� C�����Ũ���� D�����Ũ���ᣮ
���� ��1�������������Ի����¾���ǿ���������ܹ�����ͭ���ɶ���ͭ���ӣ�
��2��ֻͭ�ܺ�Ũ���ᷴӦ����ϡ�����Ӧ�����ŷ�Ӧ����Ũ����Ũ�ȼ�С��������ͭ��Ӧ����������Ӿ���ǿ�������ԣ����Ի�����ͭ���Ա����������������
��3������̼��ƺ����Ļ�ѧ���ʽ��з�����̼��ƻ������Һ������Ӧ�������ᷴӦ����������Ũ���ᡢŨ�����з����ۻ���ֹ��Ӧ���У�
��� �⣺��1��ͭ���������⡢�����ϣ���Ӧ�����Ȼ�ͭ��ˮ����ѧ����ʽ��Cu+H2O2+2HCl�T2H2O+CuCl2��
�ʴ�Ϊ��Cu+H2O2+2HCl�T2H2O+CuCl2��
��2��ֻͭ�ܺ�Ũ���ᷴӦ��ϡ�����Ӧ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+H2O������ͭ��Ũ����ķ�Ӧ�Ľ��У����Ũ��Խ��ԽС�����ٲ���������������ԭ��������0.9mol����10mol•L-1��Ũ�����ʵ�����Ҫ����180mL����ʹʣ���ͭƬ�����ܽ⣬�������м��������Σ�ӦΪ��Һ����H+���ټ�������������NO3-���൱�ڴ��������ᣬ�����ܽ�ͬ�ܽ⣬��Ӧʵ��Ϊ��3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
�ʴ�Ϊ�����ڣ�3Cu+8H++2NO3-=3Cu2++2NO��+4H2O��
��3��A��Ũ�������̼��Ʒ�Ӧ����Ҳ��Ӧ�����Լ����Ũ����ܹ������ḯʴ��������A��ѡ��
B��ϡ�������̼��Ʒ�Ӧ����Ҳ��Ӧ�����Լ����Ũ����ܹ������ḯʴ��������B��ѡ��
C�����Ũ���������ۻ������ḯʴ��������̼��Ʒ�Ӧ�ܽ�ˮ�����������⣬��Cѡ��
D������Ũ�����г����¶ۻ���Ũ������̼��Ʒ�Ӧ��������ˮ������Ƹ������������棬��ֹ��Ӧ�������У���ȥ��ˮ������D��ѡ��
��ѡ��C��
���� ���⿼����Ԫ�ػ�����֪ʶ����ȷŨ���ᡢŨ����������ǽ���ؼ���ע��ͭ�����ᷴӦ����������Ŀ�ѶȲ���

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | ����H++OH-�TH2O������ij����������Һ��Ũ��ʱ������--��ɫ | |
| B�� | ���á�2Fe3++2I-�TI2+2Fe2+����NaI��Һ����Fe��NO3��3��Ʒ��Fe��NO3��3�ٷֺ���������--��ɫ | |
| C�� | ���á�Ag++SCN-=AgSCN��ԭ�������ñ�KSCN��Һ����AgNO3��ҺŨ�ȣ�Fe��NO3��3--Ѫ ��ɫ | |
| D�� | �ñ�����KMnO4��Һ�ζ�NaHSO3��Һ�Բ�����Ũ�ȣ�KMnO4--�Ϻ�ɫ |
| W | X | Y |
| Z |
| A�� | ����Ԫ�ص�ԭ�Ӱ뾶��r��Z����r��X����r��Y����r��W�� | |
| B�� | ����Ԫ���γɵĵ��������6�� | |
| C�� | X��Y�γɵ���̬�����ﳬ������ | |
| D�� | ����Ԫ���У�Z������������Ӧ��ˮ����������ǿ |
| A�� | þԪ�ػ�̬ԭ�ӵĺ�������Ų�ʽ�ǣ�1s22s22p63s2 | |
| B�� | ��Ԫ��ԭ�Ӻ����5�ֲ�ͬ�˶�״̬�ĵ��� | |
| C�� | ��Ԫ�����Ӱ뾶�������Ӱ뾶�� | |
| D�� | ���������Ƶ�����������ˮ������Һ������Ӧ�����ӷ���ʽΪ2Al+2OH-+2H2O�T2AlO${\;}_{2}^{-}$+3H2�� |
| A�� | �ճ������е��մɡ�ˮ�ࡢ��������ʹ�����������ǽ������� | |
| B�� | �Ʒ��ס���ѹ���ȵIJ�����ǺϽ𣮺Ͻ����������������ܣ����۵�ȳɷֽ����� | |
| C�� | ��ֹ����������γɵĴ�ʩ֮һ�Ǽ���ú��ȼ�պͻ�������ʹ�� | |
| D�� | ʳƷ�����Ӧ������ζ����ʴ�Լ������Ѻã��轺������ʳƷ����� |
| A�� | �û���Ӧһ������������ԭ��Ӧ | |
| B�� | �ڷ�Ӧ��һ���г����������ˮ���� | |
| C�� | �϶���һ��Ԫ�ر���������һ��Ԫ�ر���ԭ | |
| D�� | �ֽⷴӦ���ֽⷴӦ�п�����������ԭ��Ӧ |