题目内容
1. 如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).
如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).
分析 根据电解总反应为2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑可以知道金属为阳极材料,在阳极发生失电子的氧化反应,在阴极上是氢离子发生得电子的还原反应,据此分析
解答 解:电解总反应为2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑可以知道金属Cu失电子,则Cu为阳极材料,石墨为阴极材料,阴极上氢离子得电子发生还原反应,由电解方程式可知溶液的酸碱性不变,即氢氧根离子浓度不变;
故答案为:还原;不变.
点评 本题考查学生电解池的工作原理,注意根据电解池的总反应来判断阴阳极以及两极上发生的反应,题目难度不大.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
16.向含有下列四种离子的溶液中加入少量过氧化钠固体,离子浓度未发生明显变化的是( )
| A. | HCO3- | B. | SO${\;}_{4}^{2-}$ | C. | NH${\;}_{4}^{+}$ | D. | Fe2+ |
13.1mol某金属与含3mol HNO3的稀硝酸恰好完全反应,则该金属可能是( )
| A. | Fe | B. | Al | C. | Cu | D. | Ag |
11.已知1gH2完全燃烧生成水蒸气放出热量为121kJ,有关数据如下:O=O(键能为496kJ•mol-1)、H-H(键能为436kJ•mol-1),试求H2O(g)中H-O键的键能为( )
| A. | 463kJ•mol-1 | B. | 926kJ•mol-1 | C. | 1852kJ•mol-1 | D. | 920kJ•mol-1 |

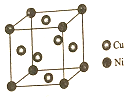 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题: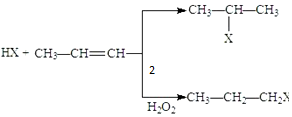 (X为卤素原子)
(X为卤素原子)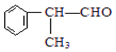 的物质,该物质是一种香料.
的物质,该物质是一种香料. $→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$
$→_{催化剂}^{①CH_{2}=CH-CH_{3}}$A$→_{一氯代物}^{②光照}$B$\stackrel{③}{→}$C$→_{HCl}^{④}$D$\stackrel{⑤}{→}$E$\stackrel{⑥氧化反应}{→}$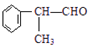
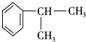 .
.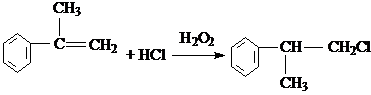 、2
、2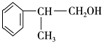 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2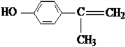 、
、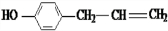 、
、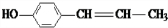 .
.