题目内容
2.下列装置可用于某些气体(或物质)的制备、干燥、性质的验证和尾气的处理(加热及夹持、固定装置均略去),请回答下列问题(仪器装置可任意选用,必要时可重复使用):
(1)当圆底烧瓶中盛装锌片,分液漏斗中盛装稀硫酸时,可验证H2的还原性并检验其氧化产物.
①仪器的连接顺序为A-D-B-B-C,两次使用B装置,其中所盛的药品依次是CuO、无水硫酸铜,证明H2有还原性的现象是左侧B中黑色物质变红色,右侧B中显蓝色.②检查好装置的气密性后,在加热B之前必须进行的操作是检验氢气的纯度.
(2)若圆底烧瓶中盛装MnO2、分液漏斗中盛装浓盐酸,B中是纯铁粉,则可选用上述装置制备纯净的FeCl3(FeCl3遇水蒸气发生反应,产生白雾).
①按气流由左向右流动的方向,选择适当的仪器与A相连进行实验,仪器的连接顺序为:A-F-D-B-G-C-/-/.(装置G干燥洁净,可用作收集FeCl2;可以不填满)
②装置A中所发生的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
③实验过程中,A、B两处均需要加热但不能同时加热,应先加热A一段时间后再点燃B处酒精灯的理由用氯气排除装置中的空气,防止加热时氧气氧化B中的单质铁.
④设计一种方案,验证实验结束后,B装置内固体中仍存在一定量的铁单质取出B装置中的固体,用吸铁石靠近它,吸铁石上有固体粉末出现.
分析 (1)①第二次使用B装置的作用是检验产物水;氢气将氧化铜还原为铜单质;
②氢气混有氧气时,加热容易发生爆炸;
(2)①制备氯化铁,FeCl3遇水蒸气会产生白雾,制得氯化铁不能接触到水蒸气,圆底烧瓶中盛装MnO2,分液漏斗中盛装浓盐酸制备氯气,氯气中含有水蒸气和氯化氢,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,得到干燥的氯气和铁加热反应生成氯化铁,氯化铁蒸气在装置G中冷却收集,最后装置连接干燥管C目的是防止空气中的水蒸气进入装置G;
②A装置中发生反应为二氧化锰和浓盐酸反应生成氯化锰,氯气和水;
③先加热A生产氯气排除装置中的空气,防止氧气氧化B中的铁;
④利用铁的磁性可解.
解答 解:(1)①第二次使用B装置的作用是检验产物水,可用无水硫酸铜;氢气将黑色氧化铜还原为红色铜单质,生成水使无水硫酸铜变蓝色;
故答案为:无水硫酸铜;左侧B中黑色物质变红色,右侧B中显蓝色;
②氢气混有氧气时,加热容易发生爆炸,所以加热前应先排尽装置中的空气,通过检验氢气的纯度,来判断,是否除尽;
故答案为:检验氢气的纯度;
(2)①制备氯化铁,FeCl3遇水蒸气会产生白雾,制得氯化铁不能接触到水蒸气,圆底烧瓶中盛装MnO2,分液漏斗中盛装浓盐酸制备氯气,氯气中含有水蒸气和氯化氢,需要通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,得到干燥的氯气和铁加热反应生成氯化铁,氯化铁蒸气在装置G中冷却收集,最后装置连接干燥管C目的是防止空气中的水蒸气进入装置G,则装置的连接顺序为A-F-D-B-G-C;
故答案为:;F;D;B;C;
②A装置中为二氧化锰和浓盐酸制备氯气,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
③铁易与氧气反应,所以先加热A一段时间用氯气排除装置中的空气,防止加热时氧气氧化B中的单质铁;
故答案为:用氯气排除装置中的空气,防止加热时氧气氧化B中的单质铁;
④铁由磁性,故方法为:取出B装置中的固体,用吸铁石靠近它,吸铁石上有固体粉末出现;
故答案为:取出B装置中的固体,用吸铁石靠近它,吸铁石上有固体粉末出现.
点评 本题考查了物质性质,实验设计方法,装置连接顺序和原则,注意知识积累,掌握基础是关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 纯碱、小苏打、烧碱均属于碱 | B. | 盐酸、水泥合金都属于混合物 | ||
| C. | 水玻璃、玻璃、漂白粉都属于纯净物 | D. | 盐类物质一定含有金属阳离子 |
| A. | 1:1 | B. | 5:3 | C. | 3:2 | D. | 7:4 |
| A. | 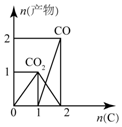 图:n(O2)=1mol,高温下C和O2在密闭容器中的反应产物 | |
| B. | 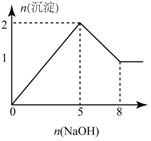 图:向含有1molMgCl2和1molAlCl3混合溶液中滴加NaOH,产生沉淀物质的量 | |
| C. | 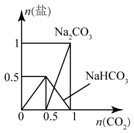 图:n(NaOH)=1mol,CO2逐步通入到NaOH溶液中反应生成的盐 | |
| D. | 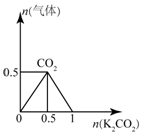 图:n(HCl)=1mol,K2CO3逐步加入到HCl溶液中,在敲口容器中生成的气体 |
①H++Z-+XO4-═X2++Z1+H2O
②2A2++B2═2A3++2B-
③2B-+Z2═B2+2Z-
由此判断下列说法中不正确的是( )
| A. | 反应Z2+2A2+═2A3++2Z-能够进行 | |
| B. | Z元素在①③反应中均被氧化 | |
| C. | 反应①的离子方程式为:16H++10Z-+2XO4-═2X2++5Z2+8H2O | |
| D. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ |
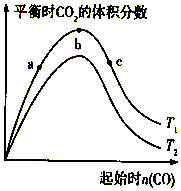 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )| A. | T1比T2高 | |
| B. | b点SO2转化率最高 | |
| C. | b点后曲线下降是因CO体积分数升高 | |
| D. | 减小压强可提高CO、SO2转化率 |

 如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).
如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).