题目内容
9. 东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
东晋《华阳国志南中志》卷四种已有关于白铜的记载,云南镍白铜(铜镍合金)文明中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:(1)镍元素基态原子的电子排布式为1s22s22p63s23p63d84s2
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液.
①在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为配位键,
②氨的沸点高于膦(PH3),原因是氨气分子之间形成氢键,分子间作用力更强;氨的中心原子的轨道杂化类型为sp3.
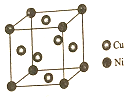
(3)某镍白铜合金的立方晶胞结构如图所示,晶胞中铜原子与镍原子的数量比为3:1.
分析 (1)Ni元素原子核外电子数为28,结合能量最低原理书写核外电子排布式;
(2)①Ni2+提供空轨道,NH3中N原子含有孤电子对,二者之间形成配位键;
②PH3分子之间为范德华力,氨气分子之间形成氢键,增大了物质的沸点;NH3分子为三角锥形结构,分子中正负电荷重心不重合,N原子有1对孤对电子,形成3个N-H键,杂化轨道数目为4;
(3)根据均摊法计算晶胞中Ni、Cu原子数目.
解答 解:(1)Ni元素原子核外电子数为28,核外电子排布式为:1s22s22p63s23p63d84s2,
故答案为:1s22s22p63s23p63d84s2;
(2)①Ni2+提供空轨道,NH3中N原子含有孤电子对,二者之间形成配位键,故答案为:配位键;
②PH3分子之间为范德华力,氨气分子之间形成氢键,分子间作用力更强,增大了物质的沸点,故氨气的沸点高于PH3分子的;
NH3分子为三角锥形结构,N原子有1对孤对电子,形成3个N-H键,杂化轨道数目为4,氮原子采取sp3杂化,
故答案为:氨气分子之间形成氢键,分子间作用力更强;sp3;
(3)晶胞中Ni处于顶点,Cu处于面心,则晶胞中Ni原子数目为8×$\frac{1}{8}$=1、Cu原子数目=6×$\frac{1}{2}$=3,故Cu与Ni原子数目之比为3:1,
故答案为:3:1.
点评 本题考查物质结构和性质,涉及核外电子排布、空间构型与杂化方式判断、配位键、氢键、晶胞计算等,注意对基础知识的理解掌握,题目难度中等.

练习册系列答案
相关题目
10.相同质量的两份含铝50%的镁铝合金,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为( )
| A. | 1:1 | B. | 5:3 | C. | 3:2 | D. | 7:4 |
11.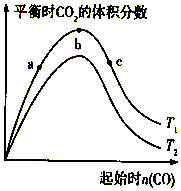 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
 燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )
燃煤脱硫可减少SO2尾气的排放,燃煤脱硫技术受到各界科研人员的关注.一种燃煤脱硫技术的原理是:CaO(s)+3CO(g)+SO2(g)?CaS(s)+3CO2(g)△H=-394.0kJ/mol.保持其他条件不变,不同温度下起始CO物质的量与平衡时体系中CO2的体积分数的关系如图所示(T表示温度):下列有关说法正确的是( )| A. | T1比T2高 | |
| B. | b点SO2转化率最高 | |
| C. | b点后曲线下降是因CO体积分数升高 | |
| D. | 减小压强可提高CO、SO2转化率 |
17.一定条件下反应N2(g)+3H2(g)?2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内N2的反应速率为( )
| A. | 1.2mol/(L•min) | B. | 1mol/(L•min) | C. | 0.6mol/(L•min) | D. | 0.4mol/(L•min) |
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6NA | |
| B. | 7.8gNa2O2固体中含有的阴离子数为0.2NA | |
| C. | 标准状况下,体积为2.24 L的CO2和SO2的混合气体中含有的氧原子数为0.2 NA | |
| D. | 0.l mol Cl2参加氧化还原反应,转移的电子数目一定是0.2NA |
19.下列说法不正确的是( )
| A. | Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液 | |
| B. | 向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<Ksp(CuS) | |
| C. | 向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色,反应方程式为2AgCl(s)+S2-(aq)?Ag2S(s)+2Cl-(aq) | |
| D. | 向2mL浓度均为1.2mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,振荡沉淀呈黄色,说明Ksp(AgCl)>Ksp(AgI) |
 如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).
如图是制备Cu2O的电解池示意图,电解总反应为:2Cu+H2O$\stackrel{通电}{?}$Cu2O+H2↑.通电时,石墨电极发生还原反应(填“氧化”或“还原”);整个电解过程中,OH-的浓度不变(填“增大”或“减小”或“不变”).
 .
.