题目内容
11.现有等体积混合而成的4组气体:①NO、NO2②NO2、O2③HCl、N2④Cl2、SO2,将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度关系为( )| A. | ④>②>③>① | B. | ④>③>②>① | C. | ②>③>①>④ | D. | ③>②>①>④ |
分析 先判断同组内各物质间是否发生化学反应,反应前后的物质是否极易溶于水,气体的溶解性越大,试管内的压强越小,水面上升的越高.
解答 解:①二氧化氮和水能反应生成硝酸和一氧化氮3NO2+H2O=2HNO3+NO,一氧化氮和水不反应,根据方程式知,气体减少的体积是二氧化氮的$\frac{2}{3}$,二氧化氮占混合气体的$\frac{1}{2}$,所以试管内气体减少的体积为试管体积的 $\frac{1}{3}$,故水面上升的高度为试管的$\frac{1}{3}$;
②二氧化氮和氧气、水能反应生成硝酸4NO2+O2+2H2O=4HNO3,根据方程式知,氧气剩余,参加反应的氧气的体积为氧气总体积的$\frac{1}{4}$,二氧化氮全部参加反应,所以混合气体减少的体积为试管体积的$\frac{5}{8}$,故水面上升的高度为试管的$\frac{5}{8}$;
③氯化氢极易溶于水,氮气和水不反应,所以混合气体减少的体积为试管体积的$\frac{1}{2}$,故水面上升的高度为试管的$\frac{1}{2}$;
④氯气和二氧化硫、水能发生氧化还原反应生成氯化氢和硫酸Cl2+SO2+2H2O=2HCl+H2SO4,且这两种物质极易溶于水,根据方程式知,这两种物质完全反应,没有气体剩余,所以水充满整只试管.
故选A.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意气体的溶解性,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.下列有关物质的性质与用途具有对应关系的是( )
| A. | 明矾溶于水能形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| B. | 氧化镁熔点高,可用于耐高温材料 | |
| C. | 碳酸钠具有碱性,可用于胃酸中和剂 | |
| D. | 铝能置换出氧化铁中的铁,可用于钢铁工业中大量冶炼铁 |
12.某实验小组同学模拟工业制碘的方法,探究ClO3-和I-的反应规律.实验操作及现象如下:
(1)取实验2后的溶液,进行如图1实验:
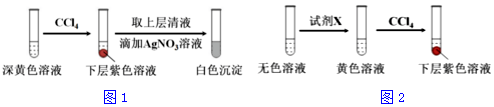
经检验,上述白色沉淀是AgCl.写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式:
ClO3-+6I-+6H+=Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图2实验,进一步佐证其中含有IO3-.其中试剂X可以是c(填字母序号).
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是进一步佐证4中生成了Cl2.
获得结论:NaClO3溶液用量增加导致溶液褪色原因是2ClO3-+I2=Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
①对比实验4和5,可以获得的结论是ClO3-和I-的反应规律与H+(或H2SO4)的用量有关
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O.
| 实验及试剂 | 编号 | 无色NaClO3溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
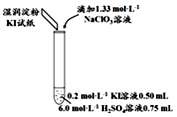 | 1 | 0.05mL | 浅黄色 | 无色 |
| 2 | 0.20mL | 深黄色 | 无色 | |
| 3 | 0.25mL | 浅黄色 | 蓝色 | |
| 4 | 0.30mL | 无色 | 蓝色 |

经检验,上述白色沉淀是AgCl.写出加入0.20mLNaClO3后,溶液中ClO3-和I-发生反应的离子方程式:
ClO3-+6I-+6H+=Cl-+3I2+3H2O.
(2)查阅资料:一定条件下,I-和I2都可以被氧化成IO3-.
作出假设:NaClO3溶液用量增加导致溶液褪色的原因是过量的NaClO3溶液与(1)中的反应产物继续反应,同时生成Cl2.
进行实验:
①取少量实验4中的无色溶液进行如图2实验,进一步佐证其中含有IO3-.其中试剂X可以是c(填字母序号).
a.碘水 b.KMnO4溶液 c.NaHSO3溶液
②有同学提出,仅通过湿润淀粉KI试纸变蓝的现象不能说明生成Cl2,便补充了如下实验:将实验4中的湿润淀粉KI试纸替换为湿润的淀粉试纸,再滴加0.30mL1.33mol•L-1NaClO3溶液后,发现湿润的淀粉试纸没有明显变化.进行以上对比实验的目的是进一步佐证4中生成了Cl2.
获得结论:NaClO3溶液用量增加导致溶液褪色原因是2ClO3-+I2=Cl2↑+2IO3-(用离子方程式表示).
(3)小组同学继续实验,通过改变实验4中硫酸溶液的用量,获得如表实验结果:
| 编号 | 6.0mol•L-1 H2SO4 溶液用量 | 试管中溶液颜色 | 淀粉KI试纸颜色 |
| 5 | 0.25mL | 浅黄色 | 无色 |
| 6 | 0.85mL | 无色 | 蓝色 |
②用离子方程式解释实验6的现象:6ClO3-+5I-+6H+=3Cl2↑+5IO3-+3H2O.
6.在标准状况下,在三个干燥的烧瓶里分别充满纯净的NH3,空气和HCl[V(空气):V(HCl)=1:4]的混合气体,O2和NO2[V(O2):V(NO2)=1:4]的混合气体,然后分别做喷泉实验.实验完毕后,三个烧瓶中溶液的物质的量浓度之比最接近(不考虑2NO2?N2O4)( )
| A. | 5:4:4 | B. | 1:1:1 | C. | 5:5:4 | D. | 3:2:1 |
16.设NA为阿伏加德罗常数的值.下列叙述不正确的是( )
| A. | 7.80g Na2O2与5.85g NaCl所含阴离子数相等 | |
| B. | 常温常压,16g氧气与臭氧的混合物,氧原子为NA | |
| C. | 一定条件下,1.4g N2和0.2mol H2混合充分反应,转移的电子数为0.3NA | |
| D. | 常温下,2L pH=12的Na2CO3溶液中含有OH-数目为0.02NA |
3.有不纯的CuCl21.35g,与足量的AgNO3溶液反应,可生成2.9g沉淀,则该氯化铜中所含的杂质可能是下列中的( )
| A. | ZnCl2 | B. | NaCl | C. | AlCl3 | D. | KCl |
20.不能产生丁达尔效应的是( )
| A. | 豆浆 | B. | 淀粉溶液 | C. | Fe(OH)3胶体 | D. | 生理盐水 |
1.下列电离方程式错误的是( )
| A. | H3PO4溶于水:H3PO4?3H++PO43- | |
| B. | (NH4)2SO4 溶于水:(NH4)2SO4═2NH4++SO42- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- HS-?H++S2- |
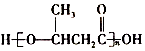 )的流程如图:
)的流程如图: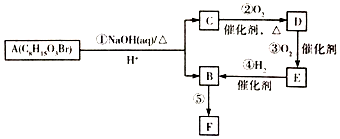
 =
=
 .
.