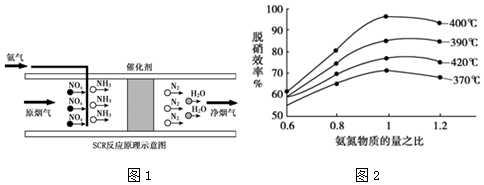
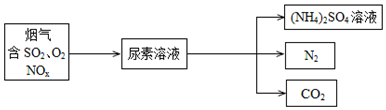
题目内容
6.在标准状况下,在三个干燥的烧瓶里分别充满纯净的NH3,空气和HCl[V(空气):V(HCl)=1:4]的混合气体,O2和NO2[V(O2):V(NO2)=1:4]的混合气体,然后分别做喷泉实验.实验完毕后,三个烧瓶中溶液的物质的量浓度之比最接近(不考虑2NO2?N2O4)( )| A. | 5:4:4 | B. | 1:1:1 | C. | 5:5:4 | D. | 3:2:1 |
分析 令烧瓶的体积均为1L,相同条件下,相同体积的气体其物质的量相等,干燥纯净的氨气,空气和HCl[V(空气):V(HCl)=1:4]的混合气体,其物质的量分别为$\frac{1}{{V}_{m}}$mol、$\frac{4}{5{V}_{m}}$mol,气体全部溶解,溶液的体积等于氨气和HCl的体积,二氧化氮和氧气(体积比为4:1)的烧瓶根据反应4NO2+O2+2H2O=4HNO3来进行计算.
解答 解:令烧瓶的体积均为1L,则干燥纯净的氨气体积为1L完全溶于水后烧瓶充满溶液溶液体积也是1L,溶质物质的量浓度为:$\frac{1}{{V}_{m}}$=$\frac{1}{22.4}$mol/L;
空气和HCl[V(空气):V(HCl)=1:4]的混合气体,HCl的物质的量为$\frac{4}{5{V}_{m}}$mol,完全溶解后烧瓶进水为$\frac{4}{5}$L,所以溶质物质的量浓度为:$\frac{\frac{4}{5{V}_{m}}}{\frac{4}{5}}$=$\frac{1}{22.4}$mol/L;
二氧化氮与氧气体积比为4:1的混合气中NO2体积为$\frac{4}{5}$L,其物质的量为$\frac{4}{5{V}_{m}}$mol,
根据以下方程式恰好完全反应:4NO2+O2+2H2O=4HNO3,而且生成硝酸物质的量为$\frac{4}{5{V}_{m}}$mol,
由于完全反应所以烧瓶充满溶液其体积为1L,所以溶质的物质的量浓度为:$\frac{\frac{4}{5{V}_{m}}}{1}$=mol/L=$\frac{0.8}{22.4}$mol/L.
所以三个烧瓶中所得溶液的溶质的物质的量浓度之比为:$\frac{1}{22.4}$:$\frac{1}{22.4}$:$\frac{0.8}{22.4}$=1:1:0.8=5:5:4,
故选C.
点评 本题考查了物质的量浓度的计算,明确二氧化氮和水反应实质是解本题关键,再利用物质的量浓度公式进行计算即可,题目难度中等,侧重于考查学生的分析能力和计算能力.

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案| A. | n(H2CO3)和c(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA | |
| B. | 5g 21H和31H的混合物发生热核聚变反应:21H+31H→42He+10n,净产生的中子(10n)数为NA | |
| C. | 1L 0.1mol/L乙醇溶液中存在的共价键总数为0.8NA | |
| D. | 56g 铁与足量氯气反应,氯气共得到3NA个电子 |
| 实验操作 | 现象 | 结论 | |
| A | 在试管中加入35mLNaAlO2溶液,再加入 过量稀盐酸,边加边振荡 | 溶液生成白色沉淀 | 制得A1(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3-?I2+I- |
| C | 将浓硫酸和乙醇混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 无明显现象 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 4He原子核内含有4个质子 | |
| B. | 3He和4He互为同位素 | |
| C. | 3He原子核内含有3个中子 | |
| D. | 4He的最外层电子数为2,故4He具有较强的金属性 |
| A. | ④>②>③>① | B. | ④>③>②>① | C. | ②>③>①>④ | D. | ③>②>①>④ |
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 9种 |
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}COO)}{c(C{H}_{3}COOH)•c(OH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+ )也增大 | |
| D. | 再加入 10mL0.1mol/L 的 NaOH 溶液,混合液的 pH=7 |