题目内容
1.下列电离方程式错误的是( )| A. | H3PO4溶于水:H3PO4?3H++PO43- | |
| B. | (NH4)2SO4 溶于水:(NH4)2SO4═2NH4++SO42- | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS═Na++HS- HS-?H++S2- |
分析 A.多元弱酸分步电离;
B.硫酸铵为强电解质,完全电离;
C.HF为弱酸,部分电离,用可逆号;
D.硫酸氢钠为强电解质,完全电离产生钠离子和硫氢根离子,硫氢根离子部分电离出氢离子和硫离子.
解答 解:A.磷酸为多元弱酸分步电离,电离方程式:H3PO4?H++H2PO4-,H2PO4-?H++HPO42-,HPO42-?H++PO43-,故A错误;
B.硫酸铵为强电解质,完全电离,电离方程式:(NH4)2SO4 溶于水:(NH4)2SO4═2NH4++SO42-,故B正确;
C.HF为弱酸,部分电离,电离方程式:HF?H++F-,故C正确;
D.硫酸氢钠为强电解质,完全电离产生钠离子和硫氢根离子,电离方程式:NaHS═Na++HS-,硫氢根离子部分电离出氢离子和硫离子,电离方程式:HS-?H++S2-,故D正确;
故选:A.
点评 本题考查了电解质电离方程式的书写,明确电解质类型及电离方式是解题关键,注意电离方程式遵循客观事实、遵循原子个数守恒、电荷守恒规律,题目难度不大.

练习册系列答案
相关题目
11.现有等体积混合而成的4组气体:①NO、NO2②NO2、O2③HCl、N2④Cl2、SO2,将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度关系为( )
| A. | ④>②>③>① | B. | ④>③>②>① | C. | ②>③>①>④ | D. | ③>②>①>④ |
9.下列除去杂质的方法不正确的是( )
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:光照条件下通入Cl2,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①③ |
16.室温下 10mL0.1mol/L 的醋酸溶液加水稀释后,下列说法正确的是( )
| A. | 溶液中导电粒子的数目减少 | |
| B. | 溶液中$\frac{c(C{H}_{3}COO)}{c(C{H}_{3}COOH)•c(OH)}$不变 | |
| C. | 醋酸的电离程度增大,c(H+ )也增大 | |
| D. | 再加入 10mL0.1mol/L 的 NaOH 溶液,混合液的 pH=7 |
13.认识反应条件对化学反应的影响,对学好化学具有重要意义.下列说法中正确的是( )
| A. | 偏铝酸钠溶液中加入一定量的盐酸,最终一定得到Al(OH)3沉淀 | |
| B. | 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 | |
| C. | 向NaOH溶液中通入少量CO2或过量CO2都只生成Na2CO3 | |
| D. | 氯化铝和少量的氨水或过量的氨水反应都得到Al(OH)3沉淀 |
10.下列物质能使潮湿的有色布条褪色的是( )
| A. | HCl | B. | NaCl | C. | CO2 | D. | 干燥的氯气 |
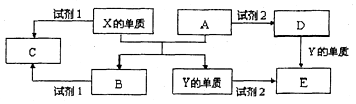 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.