题目内容
3.有不纯的CuCl21.35g,与足量的AgNO3溶液反应,可生成2.9g沉淀,则该氯化铜中所含的杂质可能是下列中的( )| A. | ZnCl2 | B. | NaCl | C. | AlCl3 | D. | KCl |
分析 假设1.35g全部为CuCl2,其物质的量为$\frac{1.35g}{135g/mol}$=0.01mol,与足量盐酸反应,由氯离子守恒可知,生成AgCl为0.01mol×2×143.5g=2.87g<2.9g,说明CuCl2样品中混有的杂质能与硝酸银反应生成AgCl,并且含有的杂质与同质量的CuCl2相比产生AgCl的质量多,即杂质中所含氯元素的质量分数高于CuCl2中氯元素的质量分数,以此来解答.
解答 解:假设1.35g全部为CuCl2,其物质的量为$\frac{1.35g}{135g/mol}$=0.01mol,与足量盐酸反应,由氯离子守恒可知,生成AgCl为0.01mol×2×143.5g=2.87g<2.9g,说明CuCl2样品中混有的杂质能与硝酸银反应生成AgCl,并且含有的杂质与同质量的CuCl2相比产生AgCl的质量多,即杂质中所含氯元素(氯离子)的质量分数高于CuCl2中氯元素(氯离子)的质量分数,
CuCl2中Cu与氯离子离子相对原子质量之比为64:71=32:35.5,
而ZnCl2中Zn与氯离子相对原子质量之比为65:71=32.5:35.5,
NaCl中Na与氯离子相对原子质量之比为23:35.5,
AlCl3中Al与氯离子相对原子质量之比为27:106.5=9:35.5,
KCl中K与氯离子相对原子质量之比为39:35.5,
故B、C中氯元素的质量分数高于氯化铜中氯元素的质量分数,均符合题意,
故选BC.
点评 本题考查混合物的计算,为高频考点,把握氯原子守恒、氯元素的质量分数判断为解答的关键,侧重分析与计算能力的考查,注意沉淀质量的应用,题目难度不大.

练习册系列答案
相关题目
6.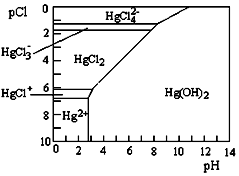 Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )
 Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )
Hg是水体污染的重金属元素之一.水溶液中 二价汞的主要存在形态与Clˉ、OHˉ的浓度关系如右图所示[图中的物质或粒子只有Hg(OH)2为难溶物;pCl=-lgc(Cl-)]下列说法中不正确的是( )| A. | 配制Hg(NO3)2溶液时,为了防止Hg2+水解,应将Hg(NO3)2固体溶于浓硝酸后再稀释 | |
| B. | 当c(Cl-)=0.1 mol•L-1,pH<8时,汞元素主要以HgCl3-形式存在 | |
| C. | HgCl2是一种弱电解质,其电离方程式是:2HgCl2?HgCl++HgCl3- | |
| D. | 当溶液pH保持在4,pCl由2改变至6时,可使HgCl2转化为Hg(OH)2 |
7.下列实验操作、现象与所得结论一致的是( )
| 实验操作 | 现象 | 结论 | |
| A | 在试管中加入35mLNaAlO2溶液,再加入 过量稀盐酸,边加边振荡 | 溶液生成白色沉淀 | 制得A1(OH)3胶体 |
| B | 向两支盛有KI3溶液的试管中,分别滴加淀粉溶液和AgNO3溶液 | 前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I3-?I2+I- |
| C | 将浓硫酸和乙醇混合加热,产生气体通入酸性KMnO4溶液 | 酸性KMnO4溶液褪色 | 产生了乙烯 |
| D | 淀粉溶液中加入几滴稀硫酸,水浴加热几分钟,再加入新制银氨溶液,水浴加热 | 无明显现象 | 淀粉未发生水解 |
| A. | A | B. | B | C. | C | D. | D |
11.现有等体积混合而成的4组气体:①NO、NO2②NO2、O2③HCl、N2④Cl2、SO2,将其分别通入体积相同的试管中并立即倒立在足量水中,试管内水面上升的高度关系为( )
| A. | ④>②>③>① | B. | ④>③>②>① | C. | ②>③>①>④ | D. | ③>②>①>④ |
18.分子式为C6H12O且官能团为-CHO的有机化合物共有(不考虑立体异构)( )
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 9种 |
13.认识反应条件对化学反应的影响,对学好化学具有重要意义.下列说法中正确的是( )
| A. | 偏铝酸钠溶液中加入一定量的盐酸,最终一定得到Al(OH)3沉淀 | |
| B. | 钠在敞口容器中存放或在空气中燃烧的产物都是Na2O2 | |
| C. | 向NaOH溶液中通入少量CO2或过量CO2都只生成Na2CO3 | |
| D. | 氯化铝和少量的氨水或过量的氨水反应都得到Al(OH)3沉淀 |