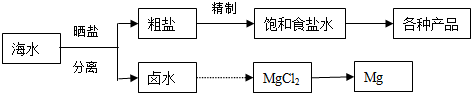
题目内容
5.碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]可用作阻燃剂,抗酸剂等,其制备方法是:控制温度、pH,向NaHCO3稀溶液中加入Al(OH)3,并搅拌,充分反应后过滤、洗涤、干燥,得碱式碳酸钠铝.(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中a、b、c、d之间的关系为a+3b=c+2d.
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③产生阻燃性气体CO2、H2O.
(3)若pH过高,则对产品的影响是pH过高会使碱式碳酸钠铝转化为NaAlO2.
(4)为确定碱式碳酸钠铝的组成,进行如下实验:
①准确称取2.880g样品用足量稀硝酸溶解,得到CO20.448L(已换算成标准状况下),并测得溶液中含有0.02molAl3+.
②加热至340℃以上样品迅速分解,得到金属氧化物、CO2和H2O,当样品分解完全时,样品的固体残留率($\frac{固体样品的剩余质量}{固体样品的起始质量}$×100%)为56.9%,根据以上实验数据确定碱式碳酸钠铝的组成(写出计算过程).
分析 (1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中,化合价代数和为0;
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③同产生不支持燃烧的二氧化碳和水;
(3)pH过高,碱性强不生成氢氧化铝,而产生偏铝酸盐;
(4)因为:n(CO2)=$\frac{0.448L}{22.4L/mol}=0.02mol$,n(CO2)=0.02mol,所以n(H2O)=$\frac{2.880g×(1-56.9%)-0.02mol×44g/mol}{18g/mol}=0.02mol$,而测得溶液中含有0.02molAl3+,所以b:c:d=1:2:1,根据电荷守恒a+0.02×3=0.02×2+0.02×2,所以a=0.02mol,所以a:b:c:d=1:1:2:1,由此分析解答.
解答 解:(1)碱式碳酸钠铝[NaaAlb(OH)c(CO3)d]中,化合价代数和为0,所以a+3b-c-2d=0,则a+3b=c+2d,故答案为:a+3b=c+2d;
(2)碱式碳酸钠铝作为阻燃剂的可能原因:①在分解过程中大量吸热;②本身及产物无毒且不可燃;③同产生不支持燃烧的二氧化碳和水,故答案为:产生阻燃性气体CO2、H2O;
(3)pH过高,碱性强不生成氢氧化铝,而产生偏铝酸盐,所以pH过高,则对产品的影响是会使碱式碳酸钠铝转化为NaAlO2,故答案为:pH过高会使碱式碳酸钠铝转化为NaAlO2;
(4)因为:n(CO2)=$\frac{0.448L}{22.4L/mol}=0.02mol$,n(CO2)=0.02mol,所以n(H2O)=$\frac{2.880g×(1-56.9%)-0.02mol×44g/mol}{18g/mol}=0.02mol$,而测得溶液中含有0.02molAl3+,所以b:c:d=1:2:1,根据电荷守恒a+0.02×3=0.02×2+0.02×2,所以a=0.02mol,所以a:b:c:d=1:1:2:1,所以,碱式碳酸铝的化学组成为NaAl(OH)2CO3,故答案为:NaAl(OH)2CO3.
点评 本题考查化学方程式有关计算,为高频考点,明确各个物理量之间关系是解本题关键,注意原子守恒的灵活运用,题目难度不大.

| A. | 氧化镁的熔点高,可用作耐火材料 | |
| B. | 碳酸钠具有弱碱性,可用作胃酸中和剂 | |
| C. | 二氧化硫具有漂白性,可用作漂白纸浆 | |
| D. | 氯化铁溶液能腐蚀铜,可用于制作印刷电路板 |
| A. | 常温下,pH=8的碱性溶液中不可能存在H2CO3分子 | |
| B. | 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同 | |
| C. | 0.1mol/LCH3COOH溶液加水稀释,溶液的pH和CH3COOH的电离度均增大 | |
| D. | 将BaCl2溶液滴入含酚酞的Na2CO3溶液,红色褪去,说明BaCl2溶液显酸性 |
| A. | 7.8g苯中碳碳双键的数目为0.3NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-的个数为NA | |
| C. | 常温常压,11.2L NO和O2混合气体的原子数为NA | |
| D. | 50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数为0.46NA |
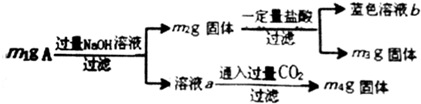
下列分析错误的是( )
| A. | 由m1、m2、m4可计算出混合物中Al、Al2O3的物质的量 | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 蓝色溶液中一定有Cu2+、Fe2+、Fe3+ | |
| D. | 当m2-m3=2.96g时,Fe3O4的质量至少为2.32g |
| A. | 加入氢氧化钠固体 | B. | 加水 | ||
| C. | 通入二氧化碳气体 | D. | 加入饱和石灰水溶液 |

 .
.