题目内容
15.欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO${\;}_{3}^{2-}$)、c(HCO3?)都减少,其方法是( )| A. | 加入氢氧化钠固体 | B. | 加水 | ||
| C. | 通入二氧化碳气体 | D. | 加入饱和石灰水溶液 |
分析 碳酸氢钠溶于水电离出碳酸氢根离子,碳酸氢根离子能电离出氢离子和碳酸根离子,且存在电离平衡,HCO3-?H++CO32-,只要加入的物质和氢离子、碳酸根离子都反应,使平衡向正反应方向移动即可.
解答 解:A.NaHCO3+NaOH=Na2CO3+H2O,所以加入氢氧化钠固体后,碳酸氢根离子浓度减小,碳酸根离子浓度增大,氢离子浓度减小,故A错误;
B.加水稀释促进水解氢氧根离子的浓度减小,氢离子浓度增大,故B错误;
C.CO2与水反应生成碳酸,c(H+)、c(HCO3-)增大,故C错误;
D.Ca(OH)2+NaHCO3=CaCO3↓+H2O+NaOH,所以加入饱和石灰水溶液后,碳酸氢根离子转化为碳酸钙沉淀,所以碳酸氢根离子浓度、碳酸根离子浓度都减小,溶液由弱碱性变为强碱性,所以氢离子浓度也减小,故D正确.
故选D.
点评 本题考查了弱电解质的电离平衡以及盐类水解知识,侧重于学生的分析能力的考查,难度不大,根据平衡移动原理分析是解本题的关键.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
6.下列有关反应进行方向的叙述中不正确的是( )
| A. | 焓变和熵变都与反应的自发性有关,又都不能独立地作为自发性的判据 | |
| B. | -10℃的液态水就会自动结冰成为固态,因为这是熵增的过程 | |
| C. | 大量事实告诉我们,过程的自发性只能用于判断过程的方向,不能确定过程是否一定会发生和过程发生的速率 | |
| D. | 放热反应过程中体系能量降低,因此有自发进行的倾向,但是有些吸热反应也可以自发进行 |
3.重铬酸钾(K2Cr2O7)是一种重要的无机试剂.
(1)①K2Cr2O7在加热条件下可以氧化浓盐酸产生氯气,其还原产物为Cr3+.该反应的离子方程式为Cr2O72-+14H++6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
②常温下,Fe2+可将Cr2O72-还原为Cr3+,利用此反应原理可处理废水中有毒的Cr2O72-.某废水中Cr2O72-的浓度为0.005 mol/L,若处理10 L该废水至少需要绿矾(FeSO4•7H2O)83.4g.
(2)K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.
①若平衡体系的pH=2,则溶液显橙色.
②高温时,向饱和Na2Cr2O7溶液中先加入少量的硫酸,再加入一定量KCl固体,降温,就会析出K2Cr2O7晶体和NaCl晶体的混合物.加入少量硫酸的原因为H2SO4电离产生的H+使Cr2O72-+H2O?2CrO42-+2H+逆向移动,从而增大了c(Cr2O72-),提高K2Cr2O7产率;不同温度下,相关物质的溶解度数据如下表所示,请分析加入KCl固体后,降温会析出K2Cr2O7晶体的原因为K2Cr2O7的溶解度随温度降低减小的幅度大,使得复分解反应Na2Cr2O7+KCl=K2Cr2O7↓+NaCl得以发生,从而析出K2Cr2O7晶体.
③向K2Cr2O7溶液中加入Ba(NO3)2和Pb(NO3)2,可析出BaCrO4和PbCrO4两种沉淀,此时溶液中$\frac{c(P{b}^{2+})}{c(B{a}^{2+})}$=2.3×10-3.[已知:Ksp(BaCrO4)=1.2×10-10;Ksp(PbCrO4)=2.8×10-13].
(1)①K2Cr2O7在加热条件下可以氧化浓盐酸产生氯气,其还原产物为Cr3+.该反应的离子方程式为Cr2O72-+14H++6Cl-$\frac{\underline{\;\;△\;\;}}{\;}$2Cr3++3Cl2↑+7H2O.
②常温下,Fe2+可将Cr2O72-还原为Cr3+,利用此反应原理可处理废水中有毒的Cr2O72-.某废水中Cr2O72-的浓度为0.005 mol/L,若处理10 L该废水至少需要绿矾(FeSO4•7H2O)83.4g.
(2)K2Cr2O7溶液中存在如下平衡:Cr2O72-(橙色)+H2O?2CrO42-(黄色)+2H+.
①若平衡体系的pH=2,则溶液显橙色.
②高温时,向饱和Na2Cr2O7溶液中先加入少量的硫酸,再加入一定量KCl固体,降温,就会析出K2Cr2O7晶体和NaCl晶体的混合物.加入少量硫酸的原因为H2SO4电离产生的H+使Cr2O72-+H2O?2CrO42-+2H+逆向移动,从而增大了c(Cr2O72-),提高K2Cr2O7产率;不同温度下,相关物质的溶解度数据如下表所示,请分析加入KCl固体后,降温会析出K2Cr2O7晶体的原因为K2Cr2O7的溶解度随温度降低减小的幅度大,使得复分解反应Na2Cr2O7+KCl=K2Cr2O7↓+NaCl得以发生,从而析出K2Cr2O7晶体.
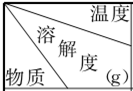 | 20℃ | 60℃ | 100℃ |
| Na2Cr2O7 | 73.2 | 82.0 | 91.4 |
| K2Cr2O7 | 13.1 | 50.5 | 96.2 |
| NaCl | 36 | 37 | 39 |
| KCl | 34 | 45.5 | 56.7 |
10.下列各组离子在溶液中能大量共存,加入OH-有沉淀析出,加入H+能放出气体的是( )
| A. | Na+、C1-、NO3-、H+ | B. | K+、Cl-、SO42-、H | ||
| C. | Fe3+、C1-、SO42-、NH4+ | D. | Ca2+、HCO3-、Cl-、NO3- |
7.有化合物X、Y、Z、W,其焰色反应均为紫色.它们按下列反应式转化:
①X+Ca(OH)2→Y+CaCO3↓
②W$\stackrel{△}{→}$X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X、Y、Z、W依次是( )
①X+Ca(OH)2→Y+CaCO3↓
②W$\stackrel{△}{→}$X+CO2↑+H2O
③Z+CO2→X+O2
④Z+H2O→Y+O2↑
则X、Y、Z、W依次是( )
| A. | KCl、KOH、K2CO3、KHCO3 | B. | K2CO3、KOH、K2O2、KHCO3 | ||
| C. | K2SO3、KOH、K2O2、KHCO3 | D. | KHCO3、KOH、K2O2、K2CO3 |
4.下列描述中,不符合生产实际的是( )
| A. | 可用电解饱和MgCl2溶液的方法获得金属镁 | |
| B. | 电解法精炼粗铜,用粗铜作阳极,纯铜作阴极 | |
| C. | 电解熔融Al2O3制备金属铝时,加入冰晶石使Al2O3更易熔化 | |
| D. | 氯碱工业中电解食盐水时,阳离子交换膜可防止氯气与NaOH溶液反应 |

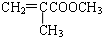 )是生产有机玻璃的单体.
)是生产有机玻璃的单体. .
. $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$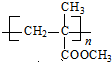 .
.