题目内容
13.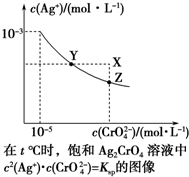 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-11 | |
| B. | 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点 | |
| C. | 在t℃,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO${\;}_{4}^{2-}$(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001 mol•L-1 AgNO3溶液滴定20 mL 0.001 mol•L-1 KCl和0.001 mol•L-1的K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
分析 A.曲线上的点是沉淀溶解平衡,溶度积是饱和溶液中离子浓度幂次方的乘积;
B.在饱和溶液中加入K2CrO4(s),c(CrO42-)增大,平衡逆向移动;
C.依据银离子浓度相同时氯化银的溶度积和Ag2CrO4(橘红色)的溶度积计算得到平衡常数;
D.依据溶液中离子浓度结合溶度积常数计算银离子浓度,银离子浓度越小先析出沉淀.
解答 解:A.曲线上的点是沉淀溶解平衡,Ag2CrO4的沉淀溶剂平衡为:Ag2CrO4(s)?2Ag++CrO42-,Ksp=c2(Ag+)c(CrO42-)=(10-3)2•10-5=10-11,故A正确;
B.在饱和溶液中加入K2CrO4可使沉淀溶解平衡左移,溶积常数不变,还是饱和溶液,点应在曲线上,故B正确;
C.在t℃时,Ag2CrO4(s)+2Cl-(aq?2AgCl(s)+CrO42-(aq);离子浓度相同时氯化银的溶度积和Ag2CrO4(橘红色)的溶度积计算,K=$\frac{c(Cr{{O}_{4}}^{2-})}{{c}^{2}(C{l}^{-})}$=$\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{{{K}_{sp}}^{2}(AgCl)}$$\frac{1{0}^{-11}}{(4×1{0}^{-10})^{2}}$=6.25×107;故C正确;
D.依据溶度积常数计算Ksp(CrO42-)=c2(Ag+)c(CrO42-)=1×10-9 ;Ksp(AgCl)=c(Ag+)c(Cl-)=4×10-10,以0.001mol/L AgNO3溶液滴定20mL0.001mol/L KCl和0.001mol/L的K2CrO4的混合溶液,c(CrO42-)=0.001mol/L,得到c(Ag+)=$\sqrt{\frac{1×1{0}^{-9}}{1{0}^{-3}}}$=1×10-3mol/L;0.001mol/L KCl溶液中,c(Cl-)=0.001mol/L;依据溶度积计算得到:(Ag+)=$\frac{4×1{0}^{-10}}{1{0}^{-3}}$=4×10-7mol/L;所以先析出氯化银沉淀,故D错误;
故选D.
点评 本题考查沉淀溶解平衡,为高频考点,侧重于学生的分析能力和计算能力的考查,题目难度中等,注意理解难溶电解质在水中的沉淀溶解平衡特点,正确理解和掌握溶度积KSP的概念.

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案| A. | Na2CO3浓度减小 | B. | Na2CO3浓度增大 | ||
| C. | Na2CO3浓度增大,并有晶体析出 | D. | Na2CO3浓度不变,并有晶体析出 |
 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).(1)能说明NaH2PO4溶液显弱酸性原因的离子方程式为H2PO4-?HPO42-+H+.
(2)能说明Na2HPO4溶液显弱碱性原因的离子方程式为HPO42-+H2O?H2PO4-+OH-.
(3)测定某三聚磷酸钠试样中Na5P3O10的含量可用间接滴定法,其流程如下:
样品1.3000g$\stackrel{稀硝酸}{→}$H3PO4$→_{调pH到3-4}^{用NaOH(aq)}$NaH2PO4→$\stackrel{配成100.00mL}{溶液A}$$\stackrel{取样}{→}$$→_{指示剂X}^{0.1000mol.L-1NaOH溶液滴}$Na2HPO4
1滴定时所用的指示剂X可为酚酞.
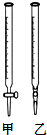
②NaOH标准溶液应盛放在如图所示的滴定管乙(选填:“甲”或“乙”) 中.
③滴定实验记录如下表(样品中杂质不与酸或碱反应).
| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol•L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
| A. | 10ml | B. | 5ml | C. | 大于5ml | D. | 小于5ml |
| A. | 碱式滴定管只用水洗,而未用待测液润洗 | |
| B. | 锥形瓶中残留有蒸馏水 | |
| C. | 酸式滴定管滴定前尖嘴处有气泡,滴定后气泡消失 | |
| D. | 滴定前仰视刻度读数,滴定后俯视刻度读数 |
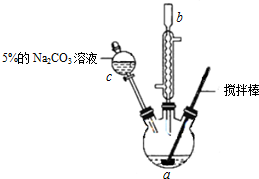
Ⅰ.实验步骤如下:
①向三颈瓶中依次加入:10.0mL丙烯酸(CH2=CHCOOH)、适量的浓硫酸、10.0mL无水甲醇、
2粒沸石,按图示装置连接好冷凝管,用搅拌棒搅拌,水浴加热.
②充分反应后,冷却,向混合液中加入5% Na2CO3溶液洗至中性.
③分液,取上层油状液体,再用无水Na2SO4干燥后蒸馏,收集70℃~90℃馏分.
可能用到的信息:
| 密度 | 沸点 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
(1)仪器c的名称是分液漏斗.
(2)混合液用5% Na2CO3溶液洗涤的作用是除去丙烯酸、浓硫酸等酸性物质.
(3)该实验中应采用的安全防护措施有通风橱中实验.(1条即可)
Ⅱ.为测定上述反应中丙烯酸甲酯的产率,设计如下实验:
①将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol/L的KOH溶液10.0mL,加热使之完全水解.
②用酚酞做指示剂,向冷却后的溶液中滴加0.5mol/L的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL.
(4)请写出(Ⅱ)操作①中发生的化学反应方程式CH2=CHCOOCH3+KOH$\stackrel{△}{→}$CH2=CHCOOK+CH3OH.
(5)计算本次酯化反应丙烯酸甲酯的产率.
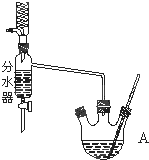 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
. 某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下:
某化学学习小组的同学 依据氧化还原反应:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,可采用滴定的方法测定FeSO4的质量分数,实验步骤如下: