题目内容
1.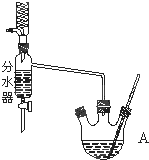 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题:I揭示实验原理
①乙酸与乙醇在催化剂存在的条件下加热可以发生反应生成乙酸乙酯.请用氧同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式
 .
.②能否用氢同位素示踪法揭示酯化反应原理?不能(选填“能”或“不能”),原因是醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基.
II反应温度确定:
合成乙酸乙酯的反应为放热反应.实验表明,反应温度应控制在85℃左右为宜.回答:
①实验温度不宜低于85℃左右的原因是反应速率低,达不到催化剂活性温度;
②实验温度不宜高于85℃左右的原因是温度过高利于平衡逆向移动,酯产率降低;
III实验装置的比较:
利用图装置制备乙酸乙酯,这种装置与教材装置相比较突出的优点是用分水器能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率.
IV酯层厚度的标示:
为更好地测定酯层厚度,可预先向饱和Na2CO3溶液中滴加1滴酚酞试液,现象是碳酸钠层呈红色,上层的酯层呈无色.
分析 I.①羧酸脱去羟基,醇脱去氢原子生成乙酸乙酯和水;
②醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基;
II.若温度低,影响反应速率;温度高,不利于乙酸乙酯的生成;
III.装置图的结构特点可知,用分水器能够在反应进行时很容易的把水分离出来;
IV.碳酸钠溶液显示碱性;乙酸乙酯不溶于碳酸钠溶液,混合液分层,颜色不同.
解答 解:I.①酯化反应中羧酸提供羟基,醇应该氢原子,所以反应的机理可以表示为 ;
;
故答案为: ;
;
②由于醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基,因此不能用氢同位素示踪法揭示酯化反应原理,
故答案为:不能; 醇和羧酸都失H,所以H换成D无法指示何种物质脱羟基;
II.①温度低,反应速率低,且达不到催化剂活性温度,所以温度不能低于85℃;
故答案为:反应速率低,达不到催化剂活性温度;
②正反应是放热反应,温度过高利于平衡逆向移动,酯产率降低,所以也不能高于85℃;
故答案为:温度过高利于平衡逆向移动,酯产率降低;
III.根据装置图的结构特点可判断,用分水器能够在反应进行时很容易的把水分离出来,从而降低生成物浓度.使平衡正向移动,提高乙酸乙酯的产率;
故答案为:用分水器能够在反应进行时很容易的把水分离出来,从而使平衡正向移动,提高乙酸乙酯的产率;
IV.由于碳酸钠溶液显碱性,能使酚酞试液显红色,所以应该滴入酚酞试液,实验现象是碳酸钠层呈红色,上层的酯层呈无色;
故答案为:酚酞;碳酸钠层呈红色,上层的酯层呈无色.
点评 本田考查了乙酸乙酯的实验室制备原理探究,题目难度中等,试题在注重对基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生规范严谨的实验设计能力以及评价能力.

练习册系列答案
相关题目
4.下列各组溶液一定呈中性的是( )
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
6.已知:25℃时,Ksp( FeS)=6.3xl0-18;ksp( CuS)=1.3xl0-36;Ksp( ZnS)=1.6xl0-24.下列叙述正确的是( )
| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
13.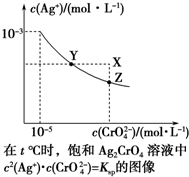 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-11 | |
| B. | 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点 | |
| C. | 在t℃,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO${\;}_{4}^{2-}$(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001 mol•L-1 AgNO3溶液滴定20 mL 0.001 mol•L-1 KCl和0.001 mol•L-1的K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
10.已知:I2+2S2O32-═S4O62-+2I-
相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入CuO或Cu(OH)2或Cu2(OH)2CO3 ,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,放置一定时间后不恢复原色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,放置一定时间后不恢复原色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
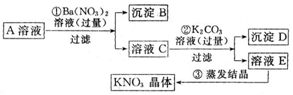

 .
.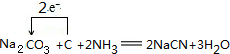 .
.