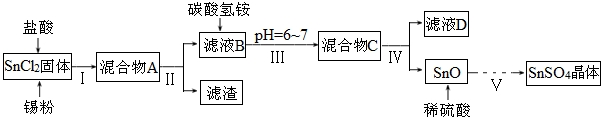
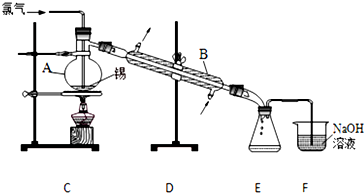
题目内容
18.现用0.1mol/LHCl滴定10ml 0.05mol/L氢氧化钠溶液,若酸式滴定管未润洗,达到终点时所用盐酸的体积应是( )| A. | 10ml | B. | 5ml | C. | 大于5ml | D. | 小于5ml |
分析 发生反应NaOH+HCl=NaCl+H2O,根据n=cV计算氢氧化钠的物质的量,再根据方程式计算消耗HCl的物质的量,根据V=$\frac{n}{c}$计算消耗盐酸的体积,若酸式滴定管未润洗,盐酸的浓度偏低,消耗盐酸体积偏大.
解答 解:10mL 0.05mol•L-1的NaOH溶液中氢氧化钠的物质的量=0.01L×0.05mol/L=5×10-4mol,
由NaOH+HCl=NaCl+H2O可知,消耗HCl的物质的量=5×10-4mol,故需要盐酸的体积=$\frac{5×1{0}^{-4}mol}{0.1mol/L}$=0.005L=5mL,若酸式滴定管未润洗,盐酸的浓度偏低,消耗盐酸体积偏大,即对于5mL,
故选C.
点评 本题考查中和滴定计算及误差分析,为高频考点,侧重于学生的分析能力和实验能力的考查,难度中等,关键是理解中和滴定原理.

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目
16.下列实验操作能达到实验目的是( )
| 实验目的 | 实验操作 | |
| A | 配制1.0mol/L CuSO4溶液 | 把25g胆矾晶体溶于水配成100mL溶液 |
| B | 证明某溶液中含有SO42- | 向该溶液中滴入BaCl2溶液 |
| C | 实验室制大量CO2 | 向稀硫酸中加入大理石 |
| D | 制备Fe(OH)3胶体 | 将饱和的FeCl3溶液滴加到热NaOH溶液中 |
| A. | A | B. | B | C. | C | D. | D |
6.已知:25℃时,Ksp( FeS)=6.3xl0-18;ksp( CuS)=1.3xl0-36;Ksp( ZnS)=1.6xl0-24.下列叙述正确的是( )
| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
13.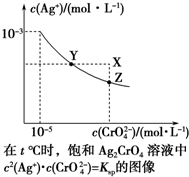 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
 已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )
已知t℃时AgCl的Ksp=4×10-10,在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是( )| A. | 在t℃时,Ag2CrO4的Ksp为1×10-11 | |
| B. | 在饱和溶液中加入K2CrO4(s)可使溶液由Y点到Z点 | |
| C. | 在t℃,Ag2CrO4(s)+2Cl-(aq)?2AgCl(s)+CrO${\;}_{4}^{2-}$(aq)平衡常数K=6.25×107 | |
| D. | 在t℃时,以0.001 mol•L-1 AgNO3溶液滴定20 mL 0.001 mol•L-1 KCl和0.001 mol•L-1的K2CrO4的混合溶液,CrO${\;}_{4}^{2-}$先沉淀 |
10.已知:I2+2S2O32-═S4O62-+2I-
相关物质的溶度积常数见下表:
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入CuO或Cu(OH)2或Cu2(OH)2CO3 ,调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=2.6×10-9mol/L.过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体.
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,放置一定时间后不恢复原色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.
相关物质的溶度积常数见下表:
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是2CuCl2•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Cu(OH)2•CuCl2+2HCl+2H2O(用化学方程式表示).
由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是在干燥的HCl气流中加热脱水.
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.36g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀.用0.100 0mol•L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00mL.
①可选用淀粉溶液作滴定指示剂,滴定终点的现象是蓝色褪去,放置一定时间后不恢复原色.
②CuCl2溶液与KI反应的离子方程式为2Cu2++4I-=2CuI↓+I2.
③该试样中CuCl2•2H2O的质量百分数为95%.

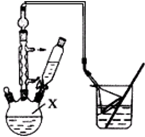 对叔丁基苯酚(
对叔丁基苯酚(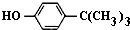 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚.
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯[(CH3)3CCl]等为原料制备对叔丁基苯酚. .
.