题目内容
8.下列物质间离子方程式书写正确的是( )| A. | 相同物质的量浓度的FeI2溶液与Br2水溶液等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | 向Ba(OH)2溶液中加入过量NH4HSO4溶液:NH4++Ba2++2OH-+H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| C. | 向漂白粉溶液中通入过量的SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 四氧化三铁溶于氢碘酸溶液中:Fe3O4+8H++2I-═3Fe2++I2+4H2O |
分析 A.溴不足只氧化碘离子;
B.硫酸氢铵过量,氢氧根离子只与氢离子反应;
C.次氯酸根具有强的氧化性,能够氧化二氧化硫生成硫酸钙;
D.碘离子容易被铁离子氧化成碘单质.
解答 解;A.相同物质的量浓度的FeI2溶液与Br2水溶液等体积混合,离子方程式:2I-+Br2=I2+2Br-,故A错误;
B.向Ba(OH)2溶液中加入过量NH4HSO4溶液,离子方程式:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故B错误;
C.漂白粉溶液中通入过量SO2的离子反应为Ca2++2ClO-+2H2O+2SO2=CaSO4↓+4H++2Cl-+SO42-,故C错误;
D.磁性氧化铁(Fe3O4)溶于氢碘酸的离子反应为2I-+Fe3O4+8H+═3Fe2++4H2O+I2,故D正确;
故选:D.
点评 本题考查了离子方程式的书写,侧重与反应物用量有关的离子反应,明确离子反应先后顺序为解题关键,题目难度中等.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
18.下列化学用语不正确的是( )
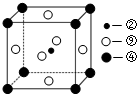
| A. | CO2分子的电子式为: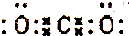 | |
| B. | 质子数为x,中子数为y的氧元素的核素符号为${\;}_{x}^{x+y}$O | |
| C. | Cl-的离子结构示意图为 | |
| D. | HClO的结构式为H-Cl-O |
16.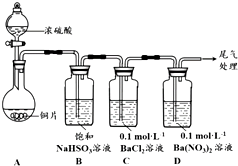 甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
(1)甲用如图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检
验均为BaSO4.
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变.甲据此得出结论:D中出现白色沉淀的主要原因是酸性条件下,含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-.
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究.
①结合化学用语解释实验1中产生现象的原因:2H++SO32-═SO2+H2O:2SO2+O2+2Ba2++2H2O═2BaSO4↓+4H+或2H2SO3+O2+2Ba2+═2BaSO4↓+4H+.
②由实验1、2、3对比,可以得到推论:含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
i.实验2和4对比,乙获得推论:Cl-的存在可以加快溶液中+4价硫元素的氧化;
ii.实验1和4对比,乙获得推论:NO3-的存在可以减慢溶液中+4价硫元素的氧化.
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加bd(填字母序号).
a.2mol•L-1盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
b.2mol•L-1盐酸,再滴加BaCl2溶液,立即出现白色沉淀
c.2mol•L-1硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
d.2mol•L-1硝酸,再滴加BaCl2溶液,立即出现白色沉淀.
 甲乙两同学分别对含+4价硫元素的物质性质进行了探究.
甲乙两同学分别对含+4价硫元素的物质性质进行了探究.(1)甲用如图装置进行实验(气密性已检验,加热和夹持装置已略去).实验进行一段时间后,C、D中都出现明显的白色沉淀,经检
验均为BaSO4.
①A中反应的化学方程式是Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②为探究SO2在D中所发生的反应,甲进一步实验发现,出现白色沉淀的过程中,D溶液中NO3-浓度几乎不变.甲据此得出结论:D中出现白色沉淀的主要原因是酸性条件下,含+4价硫元素物质(SO2或H2SO3)被O2氧化生成SO42-.
(2)乙用如下实验对含+4价硫元素的物质性质继续进行探究.
| 序号 | 实验操作 | 实验现象 |
| 1 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 盐酸,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,4min后,溶液变浑浊 |
| 2 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,2h后,溶液变浑浊 |
| 3 | 取0.3g 纯净Na2SO3固体,向其中加入10mL 浓HNO3,再滴入4滴BaCl2溶液 | 产生红棕色气体;滴入BaCl2溶液后,溶液立即产生大量白色沉淀 |
②由实验1、2、3对比,可以得到推论:含+4价硫元素物质可被O2和浓HNO3氧化.
③乙通过查阅资料发现,Na+对实验1和2中出现浑浊的时间无影响,于是进一步探究Cl-和NO3-对其的影响:
| 序号 | 实验操作 | 实验现象 |
| 4 | 取0.3g纯净Na2SO3和1.17gNaCl固体混合物,向其中加入10mL 2mol•L-1 HNO3,再滴入4滴BaCl2溶液 | 产生无色气泡;滴入BaCl2溶液后,开始无现象,20min后,溶液变浑浊 |
ii.实验1和4对比,乙获得推论:NO3-的存在可以减慢溶液中+4价硫元素的氧化.
④通过以上实验,乙同学认为,确定某溶液中含有SO42-的实验方案:取待测液,向其中先滴加bd(填字母序号).
a.2mol•L-1盐酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
b.2mol•L-1盐酸,再滴加BaCl2溶液,立即出现白色沉淀
c.2mol•L-1硝酸,再滴加BaCl2溶液,一段时间后出现白色沉淀
d.2mol•L-1硝酸,再滴加BaCl2溶液,立即出现白色沉淀.
3.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是次外层的3倍,Z原子最外层只有1个电子,W的最低负价为-3.下列叙述正确的是( )
| A. | X与W的最高正价之和为11 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | 原子半径由大到小的顺序为W、Z、Y、X | |
| D. | Y分别与X、Z形成的化合物中化学键类型相同 |
13.一种新型燃料电池,一极通入空气.另一极通入甲烷气体;电解质是掺杂氧化钇化锆(ZrO2)晶体,在熔融状态下能传导O2-,下列对该燃料电池说法正确的是( )
| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 通入空气的一极是正极,电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 通入甲烷的一极是负极,电极反应为:CH4+8e-+4O2-═CO2+2H2O | |
| D. | 当电路中通过amol电子时,理论上能生成标准状况下CO2气体2.8aL |
20.如图所示实验能鉴别的一组物质是( )


| A. | 区分淀粉溶液和鸡蛋清溶液 | B. | 鉴别乙酸和乙醇 | ||
| C. | 鉴别自来水与豆浆 | D. | 鉴别乙酸乙酯与饱和Na0H溶液 |

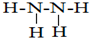 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液.
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为先产生蓝色沉淀,然后沉淀溶解,变成深蓝色溶液.