题目内容
13.一种新型燃料电池,一极通入空气.另一极通入甲烷气体;电解质是掺杂氧化钇化锆(ZrO2)晶体,在熔融状态下能传导O2-,下列对该燃料电池说法正确的是( )| A. | 在熔融电解质中,O2-由负极移向正极 | |
| B. | 通入空气的一极是正极,电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 通入甲烷的一极是负极,电极反应为:CH4+8e-+4O2-═CO2+2H2O | |
| D. | 当电路中通过amol电子时,理论上能生成标准状况下CO2气体2.8aL |
分析 在丁烷燃料电池中,负极发生氧化反应,电极反应式为CH4-8e-+4O2-=CO2+2H2O,正极发生还原反应,电极反应式为O2+4e-=2O2-,总反应式为CH4+2O2═CO2+2H2O,在原电池中,阴离子向负极移动,阳离子向正极移动,再结合氧气和二氧化碳的关系式进行计算.
解答 解:A.该装置是原电池,在熔融电解质中,氧离子由正极向负极移动,故A错误;
B.通入空气的电极是正极,正极上氧气得电子生成氧离子,其电极反应式为O2+4e-=2O2-,故B错误;
C.通入甲烷的电极是负极,负极上甲烷失电子和氧离子反应生成二氧化碳和水,电极反应式为CH4-8e-+4O2-=CO2+2H2O,故C错误;
D.该装置中电池反应式为CH4+2O2═CO2+2H2O,当电路中通过8mol电子时生成1mol二氧化碳,当转移amol电子时,能生成$\frac{a}{8}$mol二氧化碳,标况下二氧化碳的体积=$\frac{a}{8}$mol×22.4L/mol=2.8aL,故D正确.
故选D.
点评 本题考查了化学电源新型电池,根据得失电子判断正负极,难点是电极反应式的书写,注意阳极上氧气得电子生成氧离子而不是水或氢氧根离子,与电解质有关,为易错点.

练习册系列答案
相关题目
1.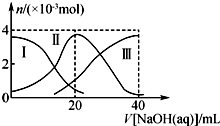 常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
 常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )
常温下,向20mL 0.2mol•L-1H2A溶液中滴加0.2mol•L-1 NaOH溶液.有关微粒的物质的量变化如右图(Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).下列说法正确的是( )| A. | H2A在水中的电离方程式为H2A═H++HA-,HA-?H++A2- | |
| B. | 向NaHA溶液中加水,HA-的电离度增大、溶液的pH减小 | |
| C. | V(NaOH)=20 mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | V(NaOH)=30 mL时,溶液中存在如下关系:2c(H+)-2c(OH-)=c(A2-)-3c(H2A)-c(HA-) |
8.下列物质间离子方程式书写正确的是( )
| A. | 相同物质的量浓度的FeI2溶液与Br2水溶液等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | 向Ba(OH)2溶液中加入过量NH4HSO4溶液:NH4++Ba2++2OH-+H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| C. | 向漂白粉溶液中通入过量的SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 四氧化三铁溶于氢碘酸溶液中:Fe3O4+8H++2I-═3Fe2++I2+4H2O |
4.(1)已知反应:Na2S2O3+H2SO4═Na2SO4+S↓+SO2+H2O.甲同学通过测定该反应发生时溶液
变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下:
其他条件不变时:探究温度对化学反应速率的影响,应选择实验②④(填实验编号);若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为5.0和10.0.
(2)某同学设计如下实验流程探究Na2S2O3的化学性质.

实验操作①中测试时pH试纸的颜色应该接近D.
A.红色 B.黄色 C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的还原性.
变浑浊的时间,研究外界条件对化学反应速率的影响.设计实验如下:
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol•L-1 | V(H2SO4)/mL | V(H2O)/mL |
| ① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
| ② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
| ③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
| ④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
(2)某同学设计如下实验流程探究Na2S2O3的化学性质.

实验操作①中测试时pH试纸的颜色应该接近D.
A.红色 B.黄色 C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的还原性.
5.将两个铂电极插人KOH溶液中,向两极分别通人CH4和O2,构成甲烷燃料电池.已知.通入CH4的一极,其电极反应式是:CH4+10OH--8e-═CO32-+7H2O;另一极通入O2.下列叙述不正确的是( )
| A. | 通人CH4的电极为负极 | |
| B. | 正极发生氧化反应 | |
| C. | 燃料电池工作时,溶液中的OH-向负极移动 | |
| D. | 该电池使用一段时间后应补充KOH |
 X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.
X与氢元素形成的化合物的电子式是[H:]-Ca2+[:H]-.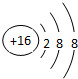 ;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.
;D与E能形成一种分子,该分子的结构式为S=C=S;D所在族元素的氢化物中,沸点最低的是硫化氢(填名称);X与E形成的离子化合物 XE2中有(填“有”“无”)共价键.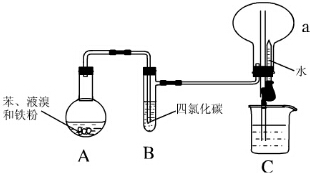 Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应.
Ⅰ.某同学设计了如图所示的实验装置(夹持装置已略去)来研究苯和溴发生的反应. .
.