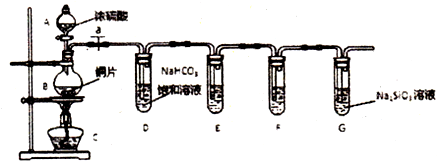
题目内容
18.下列化学用语不正确的是( )| A. | CO2分子的电子式为: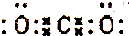 | |
| B. | 质子数为x,中子数为y的氧元素的核素符号为${\;}_{x}^{x+y}$O | |
| C. | Cl-的离子结构示意图为 | |
| D. | HClO的结构式为H-Cl-O |
分析 A.二氧化碳为共价化合物,存在2个C=O;
B.质子数+中子数=质量数;
C.氯离子核外18个电子,最外层8个电子,核内17个质子;
D.次氯酸分子的中心原子为氧原子,分子中不存在氢氯键;
解答 解:A.二氧化碳为共价化合物,存在2个C=O,电子式为: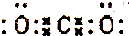 ,故A正确;
,故A正确;
B.质子数为x,中子数为y的氧元素的核素符号为${\;}_{x}^{x+y}$O,故B正确;
C.氯离子核外18个电子,最外层8个电子,核内17个质子,Cl-的离子结构示意图为 ,故C正确;
,故C正确;
D.次氯酸分子中存在1个氢氧键和1个氧氯键,次氯酸正确的结构式为:H-O-Cl,故D错误;
故选:D.
点评 本题考查了化学用语的表示方法,涉及电子式、离子结构示意图、元素符号、结构简式等化学用语的概念及书写原则,题目难度中等,侧重考查学生对化学用语使用的规范性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
8.X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
6.下列叙述正确的是( )
| A. | 由于白磷和红磷都是由P元素构成的且结构不同,故白磷和红磷互称为同分异构体 | |
| B. | H2O和D2O是同素异形体 | |
| C. | CH3-CH2-CH2-CH3和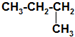 互称为同分异构体 互称为同分异构体 | |
| D. | 石英晶体是一个空间网状结构,石英晶体中不存在单个分子 |
13.下列说法正确的是( )
| A. | 乙酸和甲酸甲酯互为同分异构体 | |
| B. | H2和D2互为同素异形体 | |
| C. | CH3CH2OH与HOCH2CH2CH2OH互为同系物 | |
| D. | 35Cl与37Cl为同一种核素 |
10.下图为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素.下列说法正确的是( )
| X | |||
| Y | X | R | |
| W |
| A. | 五种元素可能都是金属元素 | |
| B. | 五种元素的原子最外层电子数一定都大于2 | |
| C. | X的氢化物的沸点一定比Z的氢化物的沸点高 | |
| D. | R的最高价氧化物对应的水化物一定是强酸 |
7.向下列物质的溶液中加入浓氢氧化钠溶液并加热,产生能使湿润的红色石蕊试纸变蓝的气体,该物质是( )
| A. | MgCl2 | B. | KNO3 | C. | NaCl | D. | (NH4)2SO4 |
8.下列物质间离子方程式书写正确的是( )
| A. | 相同物质的量浓度的FeI2溶液与Br2水溶液等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| B. | 向Ba(OH)2溶液中加入过量NH4HSO4溶液:NH4++Ba2++2OH-+H++SO42-═BaSO4↓+NH3•H2O+H2O | |
| C. | 向漂白粉溶液中通入过量的SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| D. | 四氧化三铁溶于氢碘酸溶液中:Fe3O4+8H++2I-═3Fe2++I2+4H2O |