题目内容
1.已知食盐常加人KIO3来补充碘元素,检验食盐中是否加碘,可利用如下反应:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
(1)如果反应中转移0.2mol电子,则生成I2的物质的量为0.12mol.
(2)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染.化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气) 若反应中消耗Cl2 1.5mol,则被氧化的NH3在标准状况下的体积为22.4 L.
分析 (1)根据化合价的变化和电子转移之间的关系来回答;
(2)由方程式可知,当3molNH3参加反应时,有2molNH3被氧化,根据方程式计算.
解答 解:(1)在KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O反应中,转移5mol电子生成碘单质的量是3mol,所以如果反应中转移0.2mol电子,则生成I2的物质的量为0.12moL,
故答案为:0.12;
(2)由方程式可知,当3molNH3参加反应时,有2molNH3被氧化,消耗Cl21.5mol则
3Cl2+8NH3=6NH4Cl+N2 被氧化NH3
3 2
1.5mol n
$\frac{3}{2}$=$\frac{1.5mol}{n}$,解得n=1mol,
则被氧化的NH3在标准状况下的体积为1mol×22.4L/mol=22.4L,
故答案为:22.4.
点评 本题考查氧化还原的计算,题目难度不大,注意根据反应中元素的化合价的变化分析,本题(2)注意氨气并没有全部被氧化.

练习册系列答案
相关题目
12.二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献.下列各组物质全部为合成高分子材料的是( )
| A. | 纤维素 涤纶 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 淀粉 聚异戊二烯 |
9.下列有关离子检验的叙述正确的是( )
| A. | 向某溶液中加入稀硝酸酸化,再滴入BaCl2溶液,产生白色沉淀,则原溶液中一定有SO42- | |
| B. | 向某溶液中加入稀硫酸酸化,再滴入AgNO3溶液,产生白色沉淀,则原溶液中一定有Cl- | |
| C. | 向某溶液中加入碳酸钠溶液,产生白色沉淀,再滴入稀盐酸,沉淀溶解,则原溶液中一定有Ca2+ | |
| D. | 用光洁的铂丝蘸取某无色溶液,在酒精灯外焰里灼烧时观察到黄色火焰,则原溶液中一定有Na+ |
16.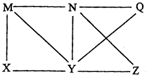 现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
 现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )| A. | X可能为Al或Cl2 | B. | Y一定为NaOH(aq) | ||
| C. | N一定是HCl(aq) | D. | Q、Z中的一种必定为Al2O3 |
13.下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
| A. | FeCl3 | B. | Cu(NO3)2 | C. | Na2SO3 | D. | Al2(SO4)3 |
 铅蓄电池的电池总反应式为:
铅蓄电池的电池总反应式为: