题目内容
13.下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )| A. | FeCl3 | B. | Cu(NO3)2 | C. | Na2SO3 | D. | Al2(SO4)3 |
分析 从盐类水解的角度和物质的稳定性的角度分析,注意当水解生成挥发性酸时,加热蒸干并灼烧最终得到的是金属氧化物,据此分析.
解答 解:A.FeCl3在加热时水解生成Fe(OH)3和HCl,HCl易挥发,灼烧得到氧化铁,所以蒸干灼烧其水溶液,不能得到该物质,故A错误;
B.Cu(NO3)3在加热时水解生成Cu(OH)2和HNO3,HNO3易挥发,灼烧得到CuO,故B错误;
C.Na2SO3在加热时能被空气中氧气氧化生成Na2SO4,最终得到Na2SO4固体,故C错误;
D.Al2(SO4)3水解生成的硫酸是难挥发性酸,最后得到的固体仍为Al2(SO4)3,故D正确.
故选D.
点评 本题考查盐类水解的应用,题目难度不大,注意盐类水解的原理,特别是能把握相关物质的性质,侧重于考查学生的分析能力.

练习册系列答案
 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
3.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的某几种.现取该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙黄色,且有无色气泡冒出 ②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成 ③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:该溶液中肯定不存在的离子组是( )
| A. | Al3+ Mg2+ I- SO32- | B. | Mg2+ Na+ CO32- I- | ||
| C. | Al3+Na+ SO32- I- | D. | Na+ CO32- Br-I- |
8.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5×6.02×1023mol-1 | |
| B. | 28g乙烯所含共用电子对数目为4×6.02×1023mol-1 | |
| C. | 1mol 苯中含有碳碳双键的数目为3×6.02×1023mol-1 | |
| D. | 2.8g聚乙烯中含有的碳原子数为0.2×6.02×1023mol-1 |
3.下列关于Fe3+、Fe2+性质实验的说法错误的是( )
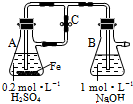

| A. | 用图装置可以制备沉淀Fe(OH)2 | |
| B. | 配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度 | |
| C. | FeCl3溶液中滴加KSCN溶液会生成红色沉淀 | |
| D. | 向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化 |
