题目内容
10.氢化铝钠(NaAlH4)是一种重要的储氢材料,已知:3NaAlH4(s)═Na3AlH6 (s)+2Al (s)+3H2(g)△H=+111kJ•molˉ1
2Na3AlH6(s)═6NaH(s)+2Al (s)+3H2(g)△H=+141kJ•molˉ1
则2NaAlH4(s)═2NaH(s)+2Al (s)+3H2(g)△H=121kJ•mol-1.
分析 根据盖斯定律,①×$\frac{2}{3}$+②×$\frac{1}{3}$可得热化学方程式:2NaAlH4(s)═2NaH(s)+2Al (s)+3H2(g),据此计算出目标反应的焓变.
解答 解:已知:①3NaAlH4(s)═Na3AlH6 (s)+2Al (s)+3H2(g)△H=+111kJ•molˉ1
②2Na3AlH6(s)═6NaH(s)+2Al (s)+3H2(g)△H=+141kJ•molˉ1
根据盖斯定律,①×$\frac{2}{3}$+②×$\frac{1}{3}$可得:2NaAlH4(s)═2NaH(s)+2Al (s)+3H2(g)△H=(+111kJ•molˉ1)×$\frac{2}{3}$+(+141kJ•molˉ1)×$\frac{1}{3}$=+121kJ•mol-1,
故答案为:121kJ•mol-1.
点评 本题考查了盖斯定律在热化学方程式计算中的应用,题目难度不大,明确盖斯定律的内容及应用方法为解答关键,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
20.分析表中各项的排布规律,有机物X是按此规律排布的第23项,下列有关X的组成、性质的说法中肯定错误的是( )
①是己酸;②是己醇;③是戊酸甲酯;④在稀硫酸中易变质;⑤一定能与钠反应.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | CH2O | CH2O2 | CH4O | C2H6 | C2H4O | C2H4O2 | C2H6O |
| A. | ③④ | B. | ①③④ | C. | ②⑤ | D. | ②③⑤ |
1.下列物质属于纯净物的是( )
| A. | 碱石灰 | B. | 正丁烷 | C. | 合金 | D. | 铝热剂 |
18.下列事实不能说明醋酸是弱酸的是( )
| A. | 室温下CH3COONa溶液的pH值大于7 | |
| B. | 同温同浓度的盐酸与CH3COOH溶液比较,醋酸溶液导电能力弱 | |
| C. | CH3COOH不与NaCl反应 | |
| D. | 室温下0.1 mol/L CH3COOH溶液的pH=2.9 |
2.同主族3种元素X、Y、Z,已知它们的最高价氧化物对应水化物的酸性HXO4>HYO4>HZO4则下列判断正确的是( )
| A. | 原子半径X>Y>Z | B. | 气态氢化物稳定性 HX>HZ>HY | ||
| C. | 非金属性X>Y>Z | D. | 气态氢化物还原性HX>HY>HZ |
19.A、B、C、D、E是短周期元素,A、B、C处于同一周期,A元素的原子最外层电子数是次外层的2倍,B2-、C-、D+、E3+具有相同电子层结构,下列说法正确的是( )
| A. | 原子序数:E>D>B>C>A | B. | 原子半径:D>E>A>C>B | ||
| C. | 最简单氢化物的热稳定性:C>B>A | D. | 离子半径:C->D+>E3+>B2- |
3.某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下实验:下列有关判断正确的是( )
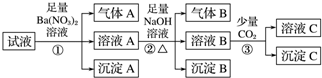

| A. | 原溶液中一定有Fe2+、SO42-、H+、NH4+、Al3+ | |
| B. | 原溶液中一定没有Ba2+、CO32-、NO3- | |
| C. | 步骤③中反应的离子方程式为2AlO-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| D. | 气体A、B之间肯定不能发生反应 |
 .
. .
.