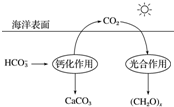
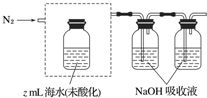
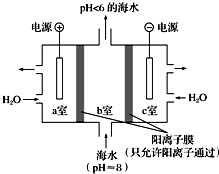
题目内容
19.A、B、C、D、E是短周期元素,A、B、C处于同一周期,A元素的原子最外层电子数是次外层的2倍,B2-、C-、D+、E3+具有相同电子层结构,下列说法正确的是( )| A. | 原子序数:E>D>B>C>A | B. | 原子半径:D>E>A>C>B | ||
| C. | 最简单氢化物的热稳定性:C>B>A | D. | 离子半径:C->D+>E3+>B2- |
分析 A、B、C、D、E是短周期元素,A元素的原子最外层电子数是次外层的2倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,则A为碳元素;A、B、C处于同一周期,B2-、C-、D+、E3+具有相同电子层结构,可推知B为O元素,C为F元素,D为Na,E为Al.
解答 解:A、B、C、D、E是短周期元素,A元素的原子最外层电子数是次外层的2倍,由于最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,则A为碳元素;A、B、C处于同一周期,B2-、C-、D+、E3+具有相同电子层结构,可推知B为O元素,C为F元素,D为Na,E为Al.
A.A为碳元素,B为O元素,C为F元素,D为Na,E为Al,故原子序数E>D>C>B>A,故A错误;
B.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>C>O>F,故B错误;
C.非金属性F>O>C,氢化物稳定性与元素非金属性一致,故C正确;
D.离子的电子层结构相同,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Al3+,故D错误.
故选C.
点评 本题考查原子结构与元素周期律,理解掌握元素周期律,会进行微粒半径比较,注意主族元素原子形成简单阳离子、阴离子时电子层及最外层电子数变化.

练习册系列答案
相关题目
9.A、B、C、D、E均为元素周期表中短周期元素,其原子序数依次递增.请结合下表信息回答问题:
(1)元素B和E形成的化合物的电子式为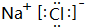 ,该化合物含有离子键(填“离子键”或“共价键”).
,该化合物含有离子键(填“离子键”或“共价键”).
(2)B的单质在A的单质中燃烧的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素D、E的最高价氧化物对应的水化物的酸性HClO4 大于H2SO4(填化学式).
(4)请举出C单质的一种用途硅芯片、太阳能电池板等.
| 元素 | 有关信息 |
| A | 位于第二周期第 VIA族 |
| B | 焰色反应呈黄色 |
| C | 无机非金属材料的主角 |
| D | 与A同主族 |
| E | 原子序数比D多1 |
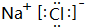 ,该化合物含有离子键(填“离子键”或“共价键”).
,该化合物含有离子键(填“离子键”或“共价键”).(2)B的单质在A的单质中燃烧的化学方程式为2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2
(3)元素D、E的最高价氧化物对应的水化物的酸性HClO4 大于H2SO4(填化学式).
(4)请举出C单质的一种用途硅芯片、太阳能电池板等.
7.X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y元素基态原子的2p轨道处于半充满状态;M为元素周期表1~36号元素中电负性最小的元素,W元素基态原子的价电子构型为3d74s2;R位于周期表第11列.回答下列问题(若需表示具体元素必须用相应的元素符号):
①X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是Co,提供孤对电子的是CO(填化学式).
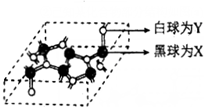
②已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石.该化合物的化学式为C3N4,其晶体类型为原子晶体,晶体中X元素原子的杂化方式为sp3.简要分析该晶体比金刚石晶体硬度大的原因C-N键的键长小于C-C键,键能大于C-C键(金刚石的密度3.51g•cm-3,该晶体密度为3.6g•cm-3)
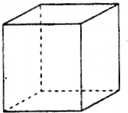
③在图(b)中标出R晶体中R原子的位置,该晶体中R原子直径为a pm,R的相对原子质量为M,阿伏加德罗常数为NA,该晶胞密度表达式为$\frac{\sqrt{2}M×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3(用a,M,NA表示).
①X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是Co,提供孤对电子的是CO(填化学式).
②已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石.该化合物的化学式为C3N4,其晶体类型为原子晶体,晶体中X元素原子的杂化方式为sp3.简要分析该晶体比金刚石晶体硬度大的原因C-N键的键长小于C-C键,键能大于C-C键(金刚石的密度3.51g•cm-3,该晶体密度为3.6g•cm-3)
 |  |
| 图(a) | 图(b) |
14.下列各项表述正确的是( )
| A. | 已知H2燃烧热△H为-285.8kJ/mol,则:2H2(g)+O2(g)═2H2O(g)△H=-571.6kJ/mol | |
| B. | 已知稀盐酸与NaOH稀溶液反应的中和热△H为-57.3kJ/mol,则:H2SO4(aq)+2NaOH(aq)═Na2SO4(aq)+2H2O(l)△H=-57.3kJ/mol | |
| C. | 电解稀硫酸可能发生反应:Cu+H2SO4$\frac{\underline{\;电解\;}}{\;}$CuSO4+H2↑ | |
| D. | 以石墨为电极电解MgCl2溶液的总离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2OH- |
11.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 标准状况下.11.2LNH3中含有N一H键的数目为1.5N | |
| B. | 足量的铜与含2mo1H2SO4的浓硫酸充分反应.可生成NA个SO2分子 | |
| C. | 标准状况下.将11.2LC12通人足量的石灰乳中制备漂白粉.转移的电子数为0.5NA | |
| D. | 常温常压下.21g氧气和27g臭氧所含的氧原子总数为3NA |
11.下列说法正确的是( )
| A. | 浓度相同的NaNO3溶液和HNO3溶液中NO3-化学性质相同 | |
| B. | 等质量的红磷和白磷完全燃烧生成P2O5(s)放出热量相同 | |
| C. | 可以通过化学反应将淀粉转化为乙酸 | |
| D. | 同温下,等体积pH相同的NH4Cl溶液和HCl溶液中由水电离出的H+数目相同 |