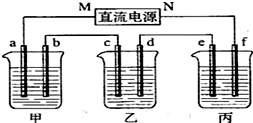
题目内容
15.W、X、Y和Z都是周期表中短周期元素,已知:①W的阳离子和Y的阴离子具有相同的核外电子排布,W、Y能组成两种离子化合物;
②Y和X属同周期元素,它们能形成两种常见的化合物;
③X和Z不在同一周期,它们能形成许多种化合物;
④W和X、Y、Z四种元素能形成一种水溶液显碱性的化合物;
(1)W元素是Na;
(2)Y和Z形成的两种常见化合物的分子式是H2O和H2O2.
(3)写出W、X、Y、Z四种元素形成的化合物与盐酸反应的离子方程式HCO3-+H+═CO2↑+H2O
(4)写出X和Z形成的一种六元环状的具有芳香气味的液态化合物跟液溴在溴化铁作用下反应的化学方程式:
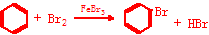 .
.
分析 W、X、Y和Z都是周期表中短周期元素,W的阳离子和Y的阴离子具有相同的核外电子排布,W、Y能组成两种离子化合物,则W为Na、Y为O;Y和X属同周期元素,它们能形成两种常见的化合物,则X为C;X和Z不在同一周期,它们能形成许多种化合物,则Z为H元素;H、C、O、Na四种元素能形成一种水溶液显碱性的化合物,则该化合物为NaHCO3,据此分析.
解答 解:W、X、Y和Z都是周期表中短周期元素,W的阳离子和Y的阴离子具有相同的核外电子排布,W、Y能组成两种离子化合物,则W为Na、Y为O;Y和X属同周期元素,它们能形成两种常见的化合物,则X为C;X和Z不在同一周期,它们能形成许多种化合物,则Z为H元素;H、C、O、Na四种元素能形成一种水溶液显碱性的化合物,则该化合物为NaHCO3,
(1)由分析可知,W为Na元素;故答案为:Na;
(2)Y为O元素,Z为H元素,二者形成的两种常见化合物的分子式是H2O、H2O2;
故答案为:H2O、H2O2;
(3)H、C、O、Na四种元素能形成一种水溶液显碱性的化合物,则该化合物为NaHCO3,碳酸氢钠与盐酸反应的离子方程式为HCO3-+H+═CO2↑+H2O;
故答案为:HCO3-+H+═CO2↑+H2O;
(4)C和H形成的一种六元环状的具有芳香气味的液态化合物为苯,苯、液溴在溴化铁作用下反应生成溴苯和HBr,其反应的化学方程式: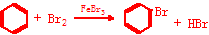
故答案为: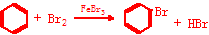
点评 本题考查位置、结构、性质的应用,元素的推断是解答本题的关键,W、Y的推断是解答本题的突破口,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.

练习册系列答案
相关题目
6.关于燃料充分利用的说法错误的是( )
| A. | 热能要充分利用 | |
| B. | 燃料充分燃烧时输入的空气量越多越好 | |
| C. | 固体燃料燃烧前要粉碎 | |
| D. | 液体燃料燃烧时可以雾状喷出 |
3.现有部分短周期主族元素的性质或原子结构如表:
(1)元素Y在周期表中的位置第二周期第ⅤA族(周期、族).
(2)XN2的电子式是: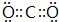 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式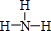 .
.
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)用电子式表示WZ的形成过程 .
.
(5)元素Z和T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是B.
A.常温下Z单质和T单质状态不同B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式2Na+2H2O=2NaOH+H2↑所得溶液的溶质是离子化合物(填“离子”或“共价”).
| 元素编号 | 元素性质或原子结构 |
| T | M层上有6个电子 |
| W | 短周期内原子半径最大的元素 |
| N | 原子序数比T小,且与T在同一主族 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氨化物的水溶液呈碱性 |
| Z | 元素最高正价为+7价 |
(2)XN2的电子式是:
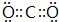 ,Y的简单氢化物的结构式
,Y的简单氢化物的结构式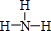 .
.(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4.
(4)用电子式表示WZ的形成过程
 .
.(5)元素Z和T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是B.
A.常温下Z单质和T单质状态不同B.Z的氢化物比T的氢化物稳定
C.一定条件下,Z和T的单质都能与氢氧化钠溶液反应
(6)写出W单质和H2O反应的化学方程式2Na+2H2O=2NaOH+H2↑所得溶液的溶质是离子化合物(填“离子”或“共价”).
7.X、Y、Z、M、W、R是元素周期表中1~36号元素,且原子序数依次增大,X、Y、Z是位于同一周期的相邻元素,Y元素基态原子的2p轨道处于半充满状态;M为元素周期表1~36号元素中电负性最小的元素,W元素基态原子的价电子构型为3d74s2;R位于周期表第11列.回答下列问题(若需表示具体元素必须用相应的元素符号):
①X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是Co,提供孤对电子的是CO(填化学式).
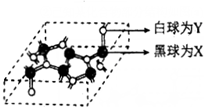
②已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石.该化合物的化学式为C3N4,其晶体类型为原子晶体,晶体中X元素原子的杂化方式为sp3.简要分析该晶体比金刚石晶体硬度大的原因C-N键的键长小于C-C键,键能大于C-C键(金刚石的密度3.51g•cm-3,该晶体密度为3.6g•cm-3)
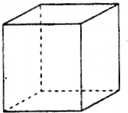
③在图(b)中标出R晶体中R原子的位置,该晶体中R原子直径为a pm,R的相对原子质量为M,阿伏加德罗常数为NA,该晶胞密度表达式为$\frac{\sqrt{2}M×1{0}^{30}}{{a}^{3}{N}_{A}}$g•cm-3(用a,M,NA表示).
①X、Z、W三种元素可以形成橘红色易升华的固体配合物W2(XZ)8,该配合物中提供空轨道的是Co,提供孤对电子的是CO(填化学式).
②已知某化合物部分结构如图(a)所示,该化合物由X、Y两元素组成,硬度超过金刚石.该化合物的化学式为C3N4,其晶体类型为原子晶体,晶体中X元素原子的杂化方式为sp3.简要分析该晶体比金刚石晶体硬度大的原因C-N键的键长小于C-C键,键能大于C-C键(金刚石的密度3.51g•cm-3,该晶体密度为3.6g•cm-3)
 |  |
| 图(a) | 图(b) |
 和
和 ;⑦
;⑦ 和
和 ;
;