题目内容
4.A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图1所示(图中产物略去)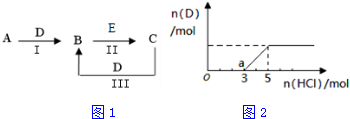
(1)若A是能使湿润的红色石蕊试纸变蓝的气体;C、D均为空气的主要成分;E是一种无色、无味的有毒气体.写出反应Ⅱ的化学方程式2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2.
(2)若A是淡黄色固体化合物;常温下D是无色气体;C中含有的阴、阳离子均为10电子的粒子.①C中所含化学键的类型是离子键和共价键,②写出反应Ⅲ的离子方程式:2OH-+CO2═CO32-+H2O.
(3)将一定量(2)中的气体D通入2L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图2(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为NaOH、Na2CO3;a点溶液中各离子浓度由大到小的关系是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
②标况下,通入气体D的体积为44.8L,C溶液的物质的量浓度为2.5mol/L.
分析 (1)若A是能使湿润的红色石蕊试纸变蓝的气体,则A为NH3,C、D均为空气的主要成分,且A与D能反应生成B,则D为O2,所以C为N2,B为NO,E是一种有毒气体,且B与E反应生成C,则E为CO;
(2)若A是淡黄色固体化合物,应是过氧化钠,则D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),验证符合转化关系;
(3)
解答 解:(1)若A是能使湿润的红色石蕊试纸变蓝的气体,则A为NH3,C、D均为空气的主要成分,且A与D能反应生成B,则D为O2,所以C为N2,B为NO,E是一种有毒气体,且B与E反应生成C,则E为CO,反应Ⅱ的化学方程式为2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2NO+2CO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(2)若A是淡黄色固体化合物,应是过氧化钠,D是二氧化碳,过氧化钠和二氧化碳反应生成碳酸钠和氧气,B和E反应生成C,C中含有的阴、阳离子均为10电子粒子,C能和二氧化碳反应生成B,所以B是碳酸钠,C是氢氧化钠,E是强碱(如氢氧化钙、氢氧化钡),
C是氢氧化钠,C中所含化学键的类型是离子键和共价键,反应Ⅲ的离子方程式为2OH-+CO2═CO32-+H2O,
故答案为:离子键和共价键;2OH-+CO2═CO32-+H2O;
(3)①据Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O+CO2↑知,Na2CO3转化为NaHCO3、NaHCO3转化为NaCl需要的HCl的物质的量相等,实际上Na2CO3需要的HCl大于NaHCO3,所以溶液中还存在NaOH;
a点时溶液中的溶质是NaHCO3和NaCl,氯化钠为强碱强酸盐,钠离子和氯离子不水解,NaHCO3为强碱弱酸酸式盐,其溶液呈碱性,则c(OH-)>c(H+),碳酸氢根离子水解程度大于电离程度,碳酸氢根离子电离生成碳酸根离子,水和碳酸氢根离子都电离生成氢离子,所以c(H+)>c(CO32-),根据元素守恒知c(Na+)>c(Cl-),根据图象知,NaOH需要HCl和碳酸钠需要HCl的物质的量之比为1:2,根据原子守恒知,生成氯化钠的物质的量和碳酸氢钠的物质的量之比为3:2,根据元素守恒知,溶液中离子浓度大小顺序是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-),
故答案为:NaOH、Na2CO3;c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);
②由图象可知,加入HCl3mol时溶质是NaHCO3和NaCl,再加入2molHCl完全反应,则可知n(CO2)=n(NaHCO3)=n(HCl)=2mol,体积为2mol×22.4L/mol=44.8L,
加入盐酸5mol时完全反应,溶液溶质为NaCl,则n(NaOH)=n(HCl)=5mol,c(NaOH)=$\frac{5mol}{2L}$=2.5mol/L,
故答案为:44.8;2.5.
点评 本题以元素化合物的推断为载体考查了元素化合物的性质,为高频考点,同时考查学生分析问题、解决问题的能力,明确物质的性质是解本题的关键,难度不大.

| A. | 原子核都是由质子和中子构成的 | |
| B. | 不同元素原子的质量数一定不等 | |
| C. | 质子数决定元素种类,质子数和中子数决定原子种类 | |
| D. | 质子数相同的粒子,其核外电子数一定相同,但化学性质不一定相同 |
| A. | 甲烷和乙烯 | B. | 苯和四氯化碳 | C. | 水和苯 | D. | 氯化钠和硝酸钾 |
| A. | 常温常压下,8.8g CO2和N2O混合物中所含有的原子数为0.6 NA | |
| B. | 二氧化锰和浓盐酸反应产生4.48L气体时,转移的电子数为0.4NA | |
| C. | 标准状况下,3.36L水中含有电子数为1.5NA | |
| D. | 在0.2mol/L的硫酸铁溶液中含有的三价铁离子数为0.6 NA |
| A. | 生成物总能量一定低于反应物总能量 | |
| B. | 等量H2在O2中完全燃烧,生成H2O(g)与生成H2O(l)放出的能量相同 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H是相同的 |
| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) | |
| B. | 0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10ml混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| D. | 浓度为0.1mol/L的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序:①>④>③>② |
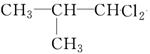 、
、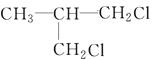 、
、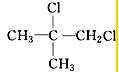 .
. .
.