题目内容
15.将2.4g某金属加入到100 mL 2mol/L的硫酸溶液中,当硫酸浓度降到原浓度的一半时(设溶液体积不变),金属还没有全部溶解.该金属可能是( )| A. | Na | B. | Mg | C. | Al | D. | Fe |
分析 稀硫酸浓度降低,说明金属与稀硫酸能反应生成氢气,令金属的相对原子质量为a、反应中化合价为b,消耗一半硫酸时金属有剩余,根据电子转移守恒列不等式,结合选项讨论确定.
解答 解:参加反应的硫酸物质的量=0.1L×2mol/L×$\frac{1}{2}$=0.1mol,令金属的相对原子质量为a、反应中化合价为b,金属还没有全部溶解,根据电子转移守,则$\frac{2.4}{a}$×b>0.1×2,
A.反应中Na的相对原子质量为23反应中化合价为+1价,代入计算得$\frac{2.4}{23}$×1<0.1×2,故A错误;
B.反应中Mg的相对原子质量为24、反应中化合价为+2价,代入计算得$\frac{2.4}{24}$×2=0.2,故B错误;
C.反应中Al的相对原子质量为27、反应中化合价为+3价,代入计算得$\frac{2.4}{27}$×3>0.1×2,符合题意,故C正确;
D.反应中Fe的相对原子质量为56、反应中化合价为+2价,代入计算得$\frac{2.4}{56}$×2<0.2,故D错误;
故选C.
点评 本题考查根据方程式计算、氧化还原反应计算,难度不大,注意利用电子转移守恒方法简化计算,转移讨论法的利用.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
5.X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻.X的核电荷数是Y核外电子数的一半,Y与M可形成化合物M2Y.下列说法正确的是( )
| A. | 还原性:X的氢化物>Y的氢化物>Z的氢化物 | |
| B. | 简单离子的半径:Y的离子>Z的离子>M的离子>X的离子 | |
| C. | YX2、M2Y都含有极性键 | |
| D. | Z元素的最高价氧化物的水化物的化学式为H2ZO4 |
3.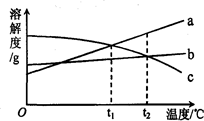 a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
( )
 a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是( )
| A. | 原饱和溶液中,溶质的质量分数a>b=c | |
| B. | 恢复至t2℃时,析出溶质的质量a>b=c | |
| C. | 恢复至t2℃时,三种溶液一定都是饱和溶液 | |
| D. | 若继续降温至t1℃,三种溶液一定都是饱和溶液 |
10.下列说法正确的是( )
| A. | NaOH的摩尔质量为40 g | |
| B. | 1 mol O2的质量与它的相对分子质量相等 | |
| C. | 1 mol OH-的质量为17 g•mol-1 | |
| D. | 氦气的摩尔质量(单位g•mol-1)在数值上等于它的相对原子质量 |
20.利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是( )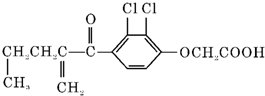

| A. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14O4Cl2 | |
| B. | 利尿酸不能发生酯化反应 | |
| C. | 1 mol利尿酸能与7 mol H2发生加成反应 | |
| D. | 利尿酸不能与FeCl3溶液发生显色反应 |
7.下列叙述正确的是( )
| A. | 用铂丝蘸取某白色晶体,放在无色的灯焰上灼烧,火焰呈黄色,说明该固体一定不含钾盐 | |
| B. | 某溶液中加入AgNO3溶液,再加入足量稀HNO3仍有白色沉淀,说明溶液中一定有Cl- | |
| C. | 某溶液中加入BaCl2溶液和足量稀HCl后,仍有白色沉淀,则原溶液中一定有SO42- | |
| D. | 某溶液中加入NaOH溶液,将湿润的红色石蕊试纸靠近试管口无颜色变化,说明原溶液中一定无NH4+ |
5.在2A+B?3C+5D反应中,表示该反应速率最快的是( )
| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=60 mol/(L•min) |