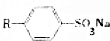
题目内容
12.漂白粉的主要成分是CaCl2、Ca(ClO)2;有效成分是Ca(ClO)2;漂白原理是(用方程式表示)Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.分析 氯气和石灰乳反应制备漂白粉,漂白粉主要成分为氯化钙和次氯酸钙,有效成分为次氯酸钙,漂白原理是次氯酸钙吸收空气中的二氧化碳和水蒸气反应生成碳酸根和次氯酸,次氯酸具有漂白作用,以此来解答.
解答 解:氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉主要成分为氯化钙和次氯酸钙,化学式为:CaCl2、Ca(ClO)2,有效成分为次氯酸钙,化学式为Ca(ClO)2 ;
漂白原理是次氯酸钙吸收空气中的二氧化碳和水蒸气反应生成碳酸根和次氯酸,次氯酸具有漂白作用,反应的化学方程式为Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO,
故答案为:CaCl2、Ca(ClO)2;Ca(ClO)2;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO.
点评 本题考查漂白粉的成分及性质,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注意含氯化合物知识的应用,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
2.氧氟沙星是常用抗菌药,其结构简式如图所示,下列对氧氟沙星叙述错误的是( )


| A. | 能发生加成、取代反应 | |
| B. | 一定条件下,1mol该物质最多消耗5mol H2 | |
| C. | 分子内共有19个氢原子 | |
| D. | 分子内共平面的碳原子多于6个 |
3. a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
( )
 a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是
a、b、c三种物质的溶解度曲线如图所示.取等质量t2℃的a、b、c三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃.下列说法不正确的是( )
| A. | 原饱和溶液中,溶质的质量分数a>b=c | |
| B. | 恢复至t2℃时,析出溶质的质量a>b=c | |
| C. | 恢复至t2℃时,三种溶液一定都是饱和溶液 | |
| D. | 若继续降温至t1℃,三种溶液一定都是饱和溶液 |
20.利尿酸在奥运会上被禁用,其结构简式如图所示.下列叙述正确的是( )

| A. | 利尿酸的衍生物利尿酸甲酯的分子式是C14H14O4Cl2 | |
| B. | 利尿酸不能发生酯化反应 | |
| C. | 1 mol利尿酸能与7 mol H2发生加成反应 | |
| D. | 利尿酸不能与FeCl3溶液发生显色反应 |
7.下列叙述正确的是( )
| A. | 用铂丝蘸取某白色晶体,放在无色的灯焰上灼烧,火焰呈黄色,说明该固体一定不含钾盐 | |
| B. | 某溶液中加入AgNO3溶液,再加入足量稀HNO3仍有白色沉淀,说明溶液中一定有Cl- | |
| C. | 某溶液中加入BaCl2溶液和足量稀HCl后,仍有白色沉淀,则原溶液中一定有SO42- | |
| D. | 某溶液中加入NaOH溶液,将湿润的红色石蕊试纸靠近试管口无颜色变化,说明原溶液中一定无NH4+ |
17.下列分子式表示的物质一定是纯净物的是( )
| A. | C5H10 | B. |  | C. | CH4O | D. | C2H4Cl2 |
1.6.5g锌恰好与125mL、2mo/L硝酸完全反应,则硝酸的还原产物为( )
| A. | NO | B. | NO2 | C. | N2O | D. | NH4NO3 |