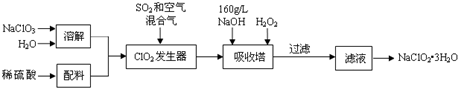
题目内容
14.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-) | |
| B. | 0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10ml混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>① | |
| D. | 浓度为0.1mol/L的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序:①>④>③>② |
分析 A.根据碳酸氢钠溶液中的质子守恒判断;
B.反应后溶质为等浓度的醋酸、醋酸钠和NaCl,氢离子浓度较小,则c(CH3COOH)>c(H+);
C.硫酸铵中铵根离子浓度最大,铝离子抑制了铵根离子的水解,据此判断铵根离子浓度大小;
D.氨水为碱溶液,其溶液中铵根离子浓度最大;其它溶液中酸根离子对应酸的酸性越弱,其水解程度越大,溶液的pH越大.
解答 解:A.根据NaHCO3溶液中的质子守恒可知:c(H+)+c(H2CO3)=c(CO32-)+c(OH-),故A正确;
B.0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10ml混合,两溶液充分反应后溶质为等浓度的醋酸、醋酸钠和NaCl,氢离子浓度较小,则c(CH3COOH)>c(H+),正确的离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B错误;
C.物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,②中的化学式中含有2个铵根离子,则其溶液中铵根离子浓度最大,③中铝离子水解抑制了铵根离子的水解,则③中铵根离子浓度大于①,所以c(NH4+)由大到小的顺序为:②>③>①,故C错误;
D.浓度为0.1mol/L的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,①为碱溶液,其溶液的pH最大;②③④为强碱弱酸盐,碳酸的酸性最强,其次为苯酚,碳酸氢根离子的酸性最弱,则水解程度③>②>④,溶液的pH大小为③>②>④,实验四种溶液的pH大小为:①>③>②>④,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒及质子守恒的含义,试题有利于提高学生的分析、理解能力及灵活应用能力.

| A. | v(A)=0.5 mol/(L•s) | B. | v(B)=0.3 mol/(L•s) | C. | v(C)=0.8 mol/(L•s) | D. | v(D)=60 mol/(L•min) |
| A. | 41.8 g固体物质为Na2CO3 | |
| B. | 41.8 g固体物质为0.1 mol Na2CO3和0.4 mol Na2O2的混合物 | |
| C. | 41.8 g固体物质为31.2 g NaHCO3和10.6 g Na2CO3的混合物 | |
| D. | 一定量的Na2O2为78 g |
| A. | 20mL 0.3mol/L的硫酸溶液 | B. | 30mL 0.2mol/L的硫酸溶液 | ||
| C. | 20mL 0.2mol/L的硫酸溶液 | D. | 10mL 0.4mol/L的硫酸溶液 |
 A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期元素,它们的核电荷数依次增大.第2周期元素A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满.请用对应的元素符号或化学式填空: