题目内容
实验室需要配制0.1mol/LNaOH溶液100mL,现有2mol/LNaOH溶液.
(1)计算所需2mol/LNaOH溶液的体积;
(2)完全中和80mL已配制好的0.1mol/LNaOH溶液,需要1mol/L的硫酸多少体积?
(1)计算所需2mol/LNaOH溶液的体积;
(2)完全中和80mL已配制好的0.1mol/LNaOH溶液,需要1mol/L的硫酸多少体积?
考点:物质的量浓度的相关计算
专题:物质的量浓度和溶解度专题
分析:(1)稀释前后溶质NaOH的物质的量不变,据此计算需要2mol/LNaOH溶液的体积;
(2)根据n=cV计算NaOH的物质的量,根据2NaOH+H2SO4=Na2SO4+2H2O计算消耗H2SO4的物质的量,再根据V=
计算硫酸溶液的体积.
(2)根据n=cV计算NaOH的物质的量,根据2NaOH+H2SO4=Na2SO4+2H2O计算消耗H2SO4的物质的量,再根据V=
| n |
| c |
解答:
解:(1)用浓溶液配制稀溶液就是溶液稀释过程,在稀释过程中溶质的物质的量不变,令需2mol/LNaOH溶液的体积为V,则:
0.1mol/L×0.1L=2mol/L×V,解得V=0.005L=5mL,
答:所需2mol/L氢氧化钠溶液的体积为5mL;
(2)80mL的1mol/L的氢氧化钠溶液中n(NaOH)=0.1mol/L×0.08L=0.008mol,
2NaOH+H2SO4=Na2SO4+2H2O
2 1
0.008mol 0.004mol
所以需要1mol/L的硫酸体积为
=0.004L,
答:完全中和80mL 0.1mol/L氢氧化钠溶液,需要1mol/L的硫酸0.004L.
0.1mol/L×0.1L=2mol/L×V,解得V=0.005L=5mL,
答:所需2mol/L氢氧化钠溶液的体积为5mL;
(2)80mL的1mol/L的氢氧化钠溶液中n(NaOH)=0.1mol/L×0.08L=0.008mol,
2NaOH+H2SO4=Na2SO4+2H2O
2 1
0.008mol 0.004mol
所以需要1mol/L的硫酸体积为
| 0.004mol |
| 1mol/L |
答:完全中和80mL 0.1mol/L氢氧化钠溶液,需要1mol/L的硫酸0.004L.
点评:本题考查物质的量浓度计算、根据方程式计算等,侧重对基础知识的巩固,注意对公式的理解与灵活应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
将30mL 0.5mol?L-1的MgCl2溶液加水稀释到500mL,稀释后溶液中Cl-的物质的量浓度为( )
| A、0.3mol?L-1 |
| B、0.03mol?L-1 |
| C、0.05mol?L-1 |
| D、0.06mol?L-1 |
下列对电离平衡常数K的叙述中,不正确的是( )
| A、与溶液的物质的量浓度有关 |
| B、只与温度有关,而与浓度无关 |
| C、根据相同条件下K的大小,可以判断弱酸的相对强弱 |
| D、升高温度K增大 |
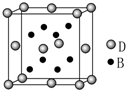 已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素.A与另外四种元素既不在同一周期,也不在同一主族.B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图.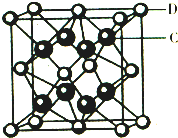 已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.