题目内容
下列对电离平衡常数K的叙述中,不正确的是( )
| A、与溶液的物质的量浓度有关 |
| B、只与温度有关,而与浓度无关 |
| C、根据相同条件下K的大小,可以判断弱酸的相对强弱 |
| D、升高温度K增大 |
考点:化学平衡常数的含义
专题:化学平衡专题
分析:电离平衡常数(K)是温度的函数,随温度的增大而增大,不随浓度的变化而变化;相同条件下K越大,酸的电离程度越大,多元弱酸各步电离平衡常数依次减小,据此分析.
解答:
解:A、电离平衡常数与温度有关,与浓度无关,故A错误;
B、电离平衡常数与温度有关,而与浓度无关,故B正确;
C、电离平衡常数的大小是衡量弱电解质电离程度的物理量,弱酸电离程度主要取决于第一步,可以判断弱酸的相对强弱,故C正确;
D、电离过程是吸热过程,升温促进电离,平衡常数增大,故D正确;
故选A.
B、电离平衡常数与温度有关,而与浓度无关,故B正确;
C、电离平衡常数的大小是衡量弱电解质电离程度的物理量,弱酸电离程度主要取决于第一步,可以判断弱酸的相对强弱,故C正确;
D、电离过程是吸热过程,升温促进电离,平衡常数增大,故D正确;
故选A.
点评:本题考查了电离平衡常数,注意电离平衡常数(K)是温度的常数,题目难度不大.

练习册系列答案
相关题目
不同温度下水的电离平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14,则下列正确的是( )
| A、c(H+)随温度的升高而增大 |
| B、水的电离过程是放热的 |
| C、水的电离平衡常数与浓度、温度有关 |
| D、在35℃时,c(H+)>c(OH─) |
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、1L0.1mol?L-1 Na2CO3溶液中有NA个CO32- |
| B、常温常压下,22gCO2中共有2NA个共用电子对 |
| C、0.1mol Na2O2与水完全反应,转移的电子数为0.2NA |
| D、2.8gN2、CO和C2H4组成的混合气体所占有的体积约为2.24L |
下列实验中试剂选用正确的是( )
| A、用稀硝酸与铁反应制取氢气 |
| B、用酒精萃取碘水中的碘 |
| C、用盐酸鉴别苏打和食盐 |
| D、用氢氧化钠溶液与可溶性铝盐制备氢氧化铝 |
已知化学式为C4H10O的醇有4种异构体,若在该分子中增加1个羰基,形成的C5H10O2的羧酸可能有的结构有( )
| A、2种 | B、4种 | C、6种 | D、5种 |
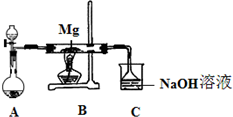 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.