题目内容
下列四种元素中(填元素符号)
(1)原子最外层有5个电子的第2周期元素是 ;
(2)位于周期表中第3周期ⅢA族的元素是 ;
(3)原子的L电子层(最外层)电子数为8的元素是 ;
(4)原子的M电子层电子数为7的元素是 .
(1)原子最外层有5个电子的第2周期元素是
(2)位于周期表中第3周期ⅢA族的元素是
(3)原子的L电子层(最外层)电子数为8的元素是
(4)原子的M电子层电子数为7的元素是
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:原子中核外电子数=原子序数,短周期元素中,每个电子层上最多排列电子数分别为2、8、8,主族元素族序数等于其最外层电子数,据此判断元素.
解答:
解:(1)原子最外层有5个电子的第2周期元素,其原子核外各个电子层上电子数分别是2、5,其原子序数为7,则该元素是N元素,故答案为:N;
(2)位于周期表中第3周期ⅢA族的元素,其原子核外各个电子层上电子数分别是2、8、3,其原子序数为13,则该元素是Al元素,故答案为:Al;
(3)原子的L电子层(最外层)电子数为8的元素,其原子核外各个电子层上电子数分别是2、8,其原子序数为10,则该元素是Ne元素,故答案为:Ne;
(4)原子的M电子层电子数为7的元素,其原子核外各个电子层上电子数分别是2、8、7,其原子序数为17,则该元素是Cl元素,故答案为:Cl.
(2)位于周期表中第3周期ⅢA族的元素,其原子核外各个电子层上电子数分别是2、8、3,其原子序数为13,则该元素是Al元素,故答案为:Al;
(3)原子的L电子层(最外层)电子数为8的元素,其原子核外各个电子层上电子数分别是2、8,其原子序数为10,则该元素是Ne元素,故答案为:Ne;
(4)原子的M电子层电子数为7的元素,其原子核外各个电子层上电子数分别是2、8、7,其原子序数为17,则该元素是Cl元素,故答案为:Cl.
点评:本题考查了元素的推断,明确原子核外电子排布规则、元素在周期表中的位置及其最外层电子数与族序数的关系即可解答,熟练掌握元素周期表结构,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目
将4gNaOH固体溶于水配成50mL溶液,其物质的量浓度为( )
| A、0.1mol/L |
| B、2mol/L |
| C、1mol/L |
| D、0.5mol/L |
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA |
| B、1mol/L的NaCl溶液中,Na+的物质的量是1mol H2 |
| C、18g H2O在标准状况下的体积是22.4L |
| D、在标准状况时,20mL NH3与60mL O2所含的分子个数比为2:1 |
含有相同分子数的下列物质,质量最小的是( )
| A、O2 |
| B、CH4 |
| C、CO2 |
| D、SO2 |
关于化学键的下列叙述正确的是( )
| A、离子化合物中不可能含有共价键 |
| B、两种不同种元素原子形成的共价键一定是非极性共价键 |
| C、共价化合物中不可能含有离子键 |
| D、非金属元素形成的化合物中不可能含有离子键 |
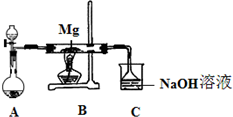 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.