题目内容
运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)= ;用离子方程式表示FeCl3溶液用于净水的原因:
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++S
.
在NaHSO4溶液中c(H+) c(OH-)+c(S
)(填“>”、“=”或“<”下同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中S
完全沉淀,则反应后溶液的pH 7
(3)将等体积的Na2SO4溶液和BaCl2溶液混合,若Na2SO4溶液的浓度为0.02mol/L,则生成BaSO4沉淀所需BaCl2溶液的最小浓度为 .已知Ksp(BaSO4)=1.1×10-10.
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=
(2)已知NaHSO4在水中的电离方程式NaHSO4=Na++H++S
| O | 2- 4 |
在NaHSO4溶液中c(H+)
| O | 2- 4 |
| O | 2- 4 |
(3)将等体积的Na2SO4溶液和BaCl2溶液混合,若Na2SO4溶液的浓度为0.02mol/L,则生成BaSO4沉淀所需BaCl2溶液的最小浓度为
考点:盐类水解的原理,pH的简单计算,难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:(1)水电离出的c(OH-)=c(H+),铁离子能水解生成胶体,胶体具有吸附性,从而净水;
(2)根据电荷守恒和物料守恒确定c(H+)与c(OH-)+c(SO42-)的关系,根据混合溶液中的溶质确定溶液的酸碱性;
(3)计算混合后硫酸根的浓度,根据Ksp(BaSO4)=c(Ba2+)?c(SO42-)计算硫酸根沉淀时溶液中c(Ba2+),原氯化钡溶液为此时钡离子浓度的2倍,注意溶液混合后各种物质的浓度降为原来的一半.
(2)根据电荷守恒和物料守恒确定c(H+)与c(OH-)+c(SO42-)的关系,根据混合溶液中的溶质确定溶液的酸碱性;
(3)计算混合后硫酸根的浓度,根据Ksp(BaSO4)=c(Ba2+)?c(SO42-)计算硫酸根沉淀时溶液中c(Ba2+),原氯化钡溶液为此时钡离子浓度的2倍,注意溶液混合后各种物质的浓度降为原来的一半.
解答:
解:(1)氯化铁是强酸弱碱盐,溶液中氢离子就是水电离出的,水电离出的c(OH-)=c(H+)=10-2mol/L,氯化铁水解生成氢氧化铁胶体,水解方程式为Fe3++3H2O?Fe(OH)3(胶体)+3H+,胶体具有吸附性,能吸附水中的悬浮物,所以能净水;
故答案为:10-2mol/L,Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)根据电荷守恒得c(H+)+C(Na+)=c(OH-)+2c(SO42-),根据物料守恒得C(Na+)=c(SO42-),所以c(H+)=c(OH-)+c(SO42-),用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应方程式为NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH,混合溶液中的溶质是氢氧化钠,所以溶液呈碱性,溶液的pH>7;
故答案为:=,>;
(3)等体积混合后,c(SO42-)=
×0.02mol/L=0.01mol/L,故BaSO4沉淀所需Ba2+离子的最小浓度为c(Ba2+)=
mol/L=1.1×10-8mol/L,故原BaCl2溶液的浓度为2×1.1×10-8mol/L=2.2×10-8mol/L;
故答案为:2.2×10-8mol/L.
故答案为:10-2mol/L,Fe3++3H2O?Fe(OH)3(胶体)+3H+;
(2)根据电荷守恒得c(H+)+C(Na+)=c(OH-)+2c(SO42-),根据物料守恒得C(Na+)=c(SO42-),所以c(H+)=c(OH-)+c(SO42-),用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应方程式为NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH,混合溶液中的溶质是氢氧化钠,所以溶液呈碱性,溶液的pH>7;
故答案为:=,>;
(3)等体积混合后,c(SO42-)=
| 1 |
| 2 |
| 1.1×10-10 |
| 0.01 |
故答案为:2.2×10-8mol/L.
点评:本题考查了离子浓度大小的比较、溶度积常数的有关计算等知识点,难度较大,(3)题是易错题,注意溶液混合后各种物质的浓度变为原来的一半,为易错点.

练习册系列答案
相关题目
设NA为阿佛加德罗常数的数值,下列说法正确的是( )
| A、1L0.1mol?L-1 Na2CO3溶液中有NA个CO32- |
| B、常温常压下,22gCO2中共有2NA个共用电子对 |
| C、0.1mol Na2O2与水完全反应,转移的电子数为0.2NA |
| D、2.8gN2、CO和C2H4组成的混合气体所占有的体积约为2.24L |
含有相同分子数的下列物质,质量最小的是( )
| A、O2 |
| B、CH4 |
| C、CO2 |
| D、SO2 |

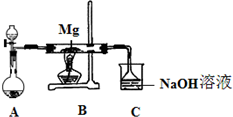 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.