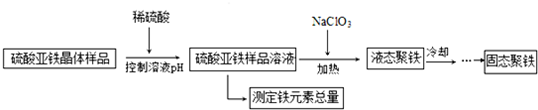
题目内容
13.1,4-丁二醇(G)可以通过如图三种不同的合成路线制备.又已知B的所有原子均处于同一平面上.
请结合下列所给信息,回答有关问题.
Ⅰ.2R-Cl+2Na$\stackrel{一定条件}{→}$R-R+2NaCl
Ⅱ.R1-C≡C-H+R2-CHO→
 (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)Ⅲ.R-C≡C-(CH2)n-CH═CH2+H2$→_{BaSO_{4}}^{Pb}$R-CH═CH-(CH2)n-CH═CH2(n≥0)
(1)写出结构简式:ECH2=CHCl,FHOCH2C≡CCH2OH.
(2)写出反应①②③的化学方程式:
①HC≡CH+2HCHO→HOCH2C≡CCH2OH.
②2CH2=CHCl+2Na→CH2=CHCH=CH2+2NaCl.
③BrCH2CH2CH2CH2Br+2NaOH→HOCH2CH2CH2CH2OH+2NaBr.
(3)请设计出B→C…→G的反应流程(有机物用结构简式表示,注明反应条件).
提示:①合成过程中无机试剂任选.
②反应流程图表示方法示例如下:
B$→_{反应条件}^{反应物}$C$→_{反应条件}^{反应物}$…$→_{反应条件}^{反应物}$G.
分析 根据各物质的转化关系,电石与水反应生成A为HC≡CH,乙炔与甲醛发生加成反应生成F为HOCH2C≡CCH2OH,H与氢气发生加成反应生成G为HOCH2CH2CH2CH2OH,2分子乙炔聚合得到B为HC≡CCH=CH2,B发生信息Ⅲ中的反应生成C为CH2=CHCH=CH2,C与溴发生加成反应生成D为BrCH2CH=CHCH2Br,D与氢气发生加成反应生成D为BrCH2CH2CH2CH2Br,D发生水解反应得到HOCH2CH2CH2CH2OH,HC≡CH与氯化氢发生加成反应生成E为CH2=CHCl,E发生信息Ⅰ中的反应生成C4H6为CH2=CHCH=CH2,与溴化氢发生加成反应生成BrCH2CH2CH2CH2Br,由HC≡CCH=CH2合成HOCH2CH2CH2CH2OH,可用HC≡CCH=CH2发生信息Ⅲ中的反应生成CH2=CHCH=CH2,CH2=CHCH=CH2与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,据此解答.
解答 解:根据各物质的转化关系,电石与水反应生成A为HC≡CH,乙炔与甲醛发生加成反应生成F为HOCH2C≡CCH2OH,H与氢气发生加成反应生成G为HOCH2CH2CH2CH2OH,2分子乙炔聚合得到B为HC≡CCH=CH2,B发生信息Ⅲ中的反应生成C为CH2=CHCH=CH2,C与溴发生加成反应生成D为BrCH2CH=CHCH2Br,D与氢气发生加成反应生成D为BrCH2CH2CH2CH2Br,D发生水解反应得到HOCH2CH2CH2CH2OH,HC≡CH与氯化氢发生加成反应生成E为CH2=CHCl,E发生信息Ⅰ中的反应生成C4H6为CH2=CHCH=CH2,与溴化氢发生加成反应生成BrCH2CH2CH2CH2Br,
(1)根据上面的分析可知,E为CH2=CHCl,F为HOCH2C≡CCH2OH,
故答案为:CH2=CHCl;HOCH2C≡CCH2OH;
(2)根据上面的分析可知,反应①的化学方程式为HC≡CH+2HCHO→HOCH2C≡CCH2OH,反应②的化学方程式为2CH2=CHCl+2Na→CH2=CHCH=CH2+2NaCl,反应 ③的化学方程式为BrCH2CH2CH2CH2Br+2NaOH→HOCH2CH2CH2CH2OH+2NaBr,
故答案为:HC≡CH+2HCHO→HOCH2C≡CCH2OH;2CH2=CHCl+2Na→CH2=CHCH=CH2+2NaCl;BrCH2CH2CH2CH2Br+2NaOH→HOCH2CH2CH2CH2OH+2NaBr;
(3)由HC≡CCH=CH2合成HOCH2CH2CH2CH2OH,可用HC≡CCH=CH2发生信息Ⅲ中的反应生成CH2=CHCH=CH2,CH2=CHCH=CH2与溴发生加成反应生成BrCH2CH=CHCH2Br,BrCH2CH=CHCH2Br与氢气发生加成反应生成BrCH2CH2CH2CH2Br,BrCH2CH2CH2CH2Br发生水解反应得到HOCH2CH2CH2CH2OH,合成路线为HC≡CCH=CH2$→_{BaSO_{4}Pb}^{H_{2}}$CH2=CHCH=CH2$\stackrel{Br_{2}}{→}$BrCH2CH=CHCH2Br$\stackrel{H_{2}}{→}$BrCH2CH2CH2CH2Br$→_{水}^{NaOH}$HOCH2CH2CH2CH2OH,
故答案为:HC≡CCH=CH2$→_{BaSO_{4}Pb}^{H_{2}}$CH2=CHCH=CH2$\stackrel{Br_{2}}{→}$BrCH2CH=CHCH2Br$\stackrel{H_{2}}{→}$BrCH2CH2CH2CH2Br$→_{水}^{NaOH}$HOCH2CH2CH2CH2OH.
点评 本题考查有机物推断与合成,判断A为乙炔,结合反应信息与HOCH2CH2CH2CH2OH进行推断,需要学生对给予的信息进行利用,较好的考查学生自学能力,难度中等.

| A. | K+ | B. | NH4+ | C. | SO42- | D. | S2- |
| A. | 分离Fe2O3、Al2O3操作依次为溶解、过滤、灼烧 | |
| B. | 粗盐可通过溶解、过滤、蒸发、结晶的方法提纯 | |
| C. | 配制氯化铁溶液,是将FeCl3溶于蒸馏水,再加入一定量的铁粉 | |
| D. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 |
| A. | 氨水溶解氯化银沉淀:AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| B. | CH3COOH溶液除去水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 酸性K2Cr2O7溶液氧化双氧水:Cr2O72-+8H++5H2O2=2 Cr3++4O2↑+9H2O | |
| D. | 将NaHSO4与Ba(OH)2溶液混合至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
 属于轴烯.可用作有机半导体基质材料的掺杂剂,其同分异构体中含有两个碳碳三键的结构有 ( )
属于轴烯.可用作有机半导体基质材料的掺杂剂,其同分异构体中含有两个碳碳三键的结构有 ( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
| A. | 向Na2CO3溶液中加入等浓度等体积的盐酸:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | NaHS溶液中:c(OH-)+c(S2-)=c(H+)+c(H2S) | |
| C. | pH相同的①CH3COONa溶液、②NaClO溶液中c(Na+):①<② | |
| D. | pH=9的0.1mol•L-1的NaHR溶液中:c(HR-)>c(H+)>c(R2-)>c(H2R) |
| A. | CO32- | B. | HCO3- | C. | Ba2+ | D. | NH4+ |
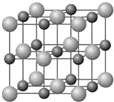 原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.
原子序数小于36的X、Y、Z和铜四种元素,X的基态原子有3个不同的能级,有一个能级中的电子数比其它两个能级的中电子数都多1;Y基态原子中的电子占有5个轨道,其中有2个轨道处于半满状态,Z的原子序数为24.