题目内容
13.五种短周期元素的某些性质如表所示,下列说法正确的是( )| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 71 | 74 | 77 | 186 |
| 主要化合价 | +1 | -1 | -2 | +4、-4 | +1 |
| A. | X和Q都属于金属元素 | |
| B. | Y和Z的基态原子s能级和p能级电子数相同 | |
| C. | Y和W的第一电离能大小比较:Y>W | |
| D. | X、Z形成的化合物分子中可能既有σ键又有π键 |
分析 原子的电子层数越大,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,在短周期元素中,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,
根据表中数据知,X的原子半径最小,且其正化合价为+1,则X位于第IA族;W、Y、Z为同周期元素,根据其化合价知,W为第VIIA族、Y为第VIA族、Z为第ⅣA族元素,Q为第IA族元素,其原子半径最大,且为短周期元素,所以Q是Na元素,W、Y、Z都属于第二周期元素,所以W是F元素、Y是O元素、Z是C元素,X原子半径小于W,所以X是H元素,再结合物质的结构分析解答.
解答 解:原子的电子层数越大,其原子半径越大,同一周期元素中,原子半径随着原子序数增大而减小,在短周期元素中,元素的最高正化合价与其族序数相等,最低负化合价=族序数-8,根据表中数据知,X的原子半径最小,且其正化合价为+1,则X位于第IA族;W、Y、Z为同周期元素,根据其化合价知,W为第VIIA族、Y为第VIA族、Z为第ⅣA族元素,Q为第IA族元素,其原子半径最大,且为短周期元素,所以Q是Na元素,W、Y、Z都属于第二周期元素,所以W是F元素、Y是O元素、Z是C元素,X原子半径小于W,所以X是H元素,
A.由以上分析可知X为H元素,为非金属,故A错误;
B.O和C的基态p能级电子数不同,分别为4和2,故B错误;
C.同周期元素从左到右元素的第一电离能逐渐增大,O<F,故C错误;
D.C、H形成的化合物如为乙烯、乙炔等,则既有σ键又有π键,故D正确.
故选D.
点评 本题考查了原子结构和元素周期律的关系,为高频考点,根据元素的原子半径、化合价结合元素周期律来推断元素,正确推断元素是解本题关键,再结合物质的结构来分析解答,难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目
3.DAP是电器和仪表部件中常用的一种合成高分子化合物,它的结构简式为:
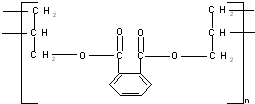
则合成此高分子的单体可能是( )
①乙烯CH2=CH2 ②丙烯CH3CH=CH2③丙烯醇HOCH2CH=CH2④邻苯二甲酸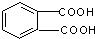 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 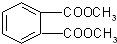

则合成此高分子的单体可能是( )
①乙烯CH2=CH2 ②丙烯CH3CH=CH2③丙烯醇HOCH2CH=CH2④邻苯二甲酸
 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
4.下列实验操作正确的是( )


| A. | 用pH试纸测定浓硫酸的pH | |
| B. | 向碘酒中加入CCl4,静置后分液,可以分离碘酒中的碘 | |
| C. | 用甲图装置验证FeCl3对H2O2分解反应有催化作用 | |
| D. | 用乙图装置验证NaHCO3和Na2CO3的热稳定性 |
1.短周期主族元素X、Y、Z、W的原子序数依次增大.其中X、Z同主族,Z的单质是一种良好的半导体材料,Y元素原子最外层电子数等于其电子层数,W是同周期中原子半径最小的元素.下列叙述正确的是( )
| A. | Y的简单离子半径小于W的简单离子半径 | |
| B. | W、X形成的化合物为离子化合物 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | Z的气态简单氢化物的稳定性比X的强 |
8.如图1所示是实验室中制取气体的一种简易装置.
(1)请简述检验它的气密性的方法关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好.
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)不溶于水的块状固体、不需要加热而反应生成的气体.
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.

(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为2.95mol/L(计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和量筒.
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH$\stackrel{高温}{→}$2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是d.
a.HNO3的氧化性比KNO3弱 b.反应的温度不够
c.HNO3的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等.请设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
(1)请简述检验它的气密性的方法关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好.
(2)利用如图1所示装置可以制取(填反应物状况及发生反应是否需要的条件)不溶于水的块状固体、不需要加热而反应生成的气体.
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态.请回答有关问题.

(3)已知16.9%稀硝酸的密度为1.10g/cm3,则其物质的量浓度为2.95mol/L(计算结果保留两位小数).用若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有玻璃棒、烧杯和量筒.
(4)当打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是有红棕色气体出现.B装置烧杯中液体的作用是吸收NO2.当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体.
(5)已知下列反应可以发生:Fe2O3+3KNO3+4KOH$\stackrel{高温}{→}$2K2FeO4+3KNO2+2H2O,而A装置中的稀硝酸即使换成浓硝酸,也不能生成+6价的铁的化合物,其原因是d.
a.HNO3的氧化性比KNO3弱 b.反应的温度不够
c.HNO3的热稳定性比KNO3差 d.FeO42-不能存在于酸性溶液中
(6)现有仪器和药品:试管和胶头滴管,0.1mol/LKSCN溶液、0.2mol/L酸性KMnO4溶液、0.1mol/LKI溶液、氯水等.请设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液. | |
| 第二步 | 若溶液紫色褪去,则说明含有Fe2+; 若无明显变化,则说明不含Fe2+. |
18.NA表示阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 用铜作电极电解饱和食盐水,当线路中通过NA个电子时,阳极生成11.2L气体(标准状况下) | |
| B. | 把5.6g铁片投入到足量的冷的浓硝酸中,转移电子数为0.3NA | |
| C. | 12g石墨晶体中含有碳碳单键数为1.5NA | |
| D. | 15g-CH3中含有的电子数为10NA |
2.常温下,测得0.1mol•L-1某溶液的pH值大于7,则该溶液中可能的溶质为( )
| A. | KCl | B. | NH3 | C. | NaNO3 | D. | CH3COOH |
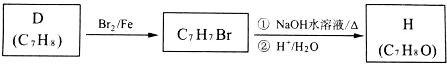
 .
.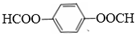 .
.