题目内容
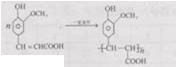
3.DAP是电器和仪表部件中常用的一种合成高分子化合物,它的结构简式为: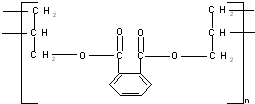
则合成此高分子的单体可能是( )
①乙烯CH2=CH2 ②丙烯CH3CH=CH2③丙烯醇HOCH2CH=CH2④邻苯二甲酸
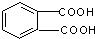 ⑤邻苯二甲酸甲酯
⑤邻苯二甲酸甲酯 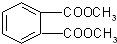
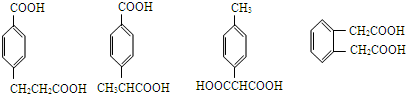
| A. | ①② | B. | ③④ | C. | ②④ | D. | ③⑤ |
分析 有机物含有酯基,应由酸和醇发生酯化反应,对应的单质分别含有羟基、羧基,且为二元酸,链节中主碳链为2个碳原子,对应的单体含有碳碳双键,以此解答该题.
解答 解:按如图 所示断键后,氧原子接H原子,碳原子接-OH,再将两端的半键连接成双键,所以可得单体为
所示断键后,氧原子接H原子,碳原子接-OH,再将两端的半键连接成双键,所以可得单体为 和CH2=CH-CH2-OH,
和CH2=CH-CH2-OH,
故选B.
点评 本题考查高分子化合物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意根据链节判断高聚物是加聚、还是缩聚而成是关键,注意理解结合反应的机理,难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
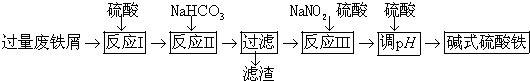
8.碱式硫酸铁[Fe(OH)SO4]可用作净水剂、媒染剂、颜料和药物.工业上利用废铁屑(含少量氧化铝、氧化铁等)生成碱式硫酸铁的部分工艺如图:
已知:部分阳离子以氢氧化物形式沉淀时溶剂的pH见表:
(1)反应Ⅰ中发生的氧化还原反应的离子方程式是Fe+2H+═Fe2++H2↑、Fe+2Fe3+═3Fe2+.
(2)反应Ⅱ中加入NaHCO3调节体系PH在4.4≤pH<7.5 范围内.
(3)反应Ⅲ中生成的气体遇空气变红棕色,则反应Ⅲ中发生反应的离子方程式是2H++Fe2++NO2-=Fe3++NO↑+H2O.
(4)反应Ⅲ中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=4mol.
(5)用硫酸控制体系的PH,若硫酸加入量过小,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动,不利于产物生成.
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)${\;}_{4}^{2+}$聚合离子,该水解反应的离子方程式是2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.

已知:部分阳离子以氢氧化物形式沉淀时溶剂的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中加入NaHCO3调节体系PH在4.4≤pH<7.5 范围内.
(3)反应Ⅲ中生成的气体遇空气变红棕色,则反应Ⅲ中发生反应的离子方程式是2H++Fe2++NO2-=Fe3++NO↑+H2O.
(4)反应Ⅲ中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=4mol.
(5)用硫酸控制体系的PH,若硫酸加入量过小,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动,不利于产物生成.
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)${\;}_{4}^{2+}$聚合离子,该水解反应的离子方程式是2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.
13.五种短周期元素的某些性质如表所示,下列说法正确的是( )
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 71 | 74 | 77 | 186 |
| 主要化合价 | +1 | -1 | -2 | +4、-4 | +1 |
| A. | X和Q都属于金属元素 | |
| B. | Y和Z的基态原子s能级和p能级电子数相同 | |
| C. | Y和W的第一电离能大小比较:Y>W | |
| D. | X、Z形成的化合物分子中可能既有σ键又有π键 |
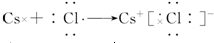 .
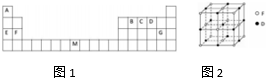
.
 现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题:
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们均位于元素周期表有前四周期,A与B位于不同周期且B元素的原子含有3个能级,B元素原子的每个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子.请回答下列问题: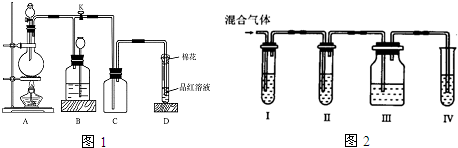
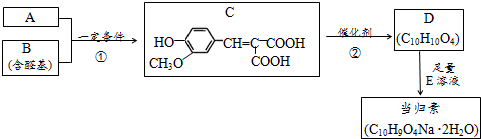
 ;
; ;
; (其中两种).
(其中两种).