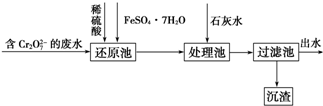
题目内容
18.NA表示阿伏伽德罗常数的数值,下列说法正确的是( )| A. | 用铜作电极电解饱和食盐水,当线路中通过NA个电子时,阳极生成11.2L气体(标准状况下) | |
| B. | 把5.6g铁片投入到足量的冷的浓硝酸中,转移电子数为0.3NA | |
| C. | 12g石墨晶体中含有碳碳单键数为1.5NA | |
| D. | 15g-CH3中含有的电子数为10NA |
分析 A.铜做电极,阳极失去电子的为金属铜;
B.铁遇浓硝酸发生钝化;
C.石墨中每个C原子与其它3个C形成碳碳键,根据均摊法计算出12g石墨中含有的碳碳键;
D.1个甲基含有9个电子;
解答 解:A.用铜作电极电解饱和NaCl溶液,阳极失去电子的是金属铜,不会生成气体,故A错误;
B.铁遇浓硝酸发生钝化所以转移电子数小于0.3NA,故B错误;
C.12g石墨中含有1molC,石墨中每个碳原子与其它3个C形成碳碳单键,每个C形成的碳碳键为:$\frac{1}{2}$×3=1.5,所以1molC形成了1.5mol碳碳键,12g石墨含有碳碳键数目为1.5NA,故C正确;
D.15g-CH3物质的量为1mol,含有的电子数为9NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的判断及计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,注意石墨、甲基的结构特点.

练习册系列答案
相关题目
8.碱式硫酸铁[Fe(OH)SO4]可用作净水剂、媒染剂、颜料和药物.工业上利用废铁屑(含少量氧化铝、氧化铁等)生成碱式硫酸铁的部分工艺如图:
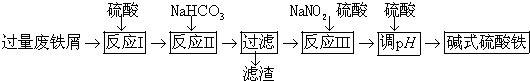
已知:部分阳离子以氢氧化物形式沉淀时溶剂的pH见表:
(1)反应Ⅰ中发生的氧化还原反应的离子方程式是Fe+2H+═Fe2++H2↑、Fe+2Fe3+═3Fe2+.
(2)反应Ⅱ中加入NaHCO3调节体系PH在4.4≤pH<7.5 范围内.
(3)反应Ⅲ中生成的气体遇空气变红棕色,则反应Ⅲ中发生反应的离子方程式是2H++Fe2++NO2-=Fe3++NO↑+H2O.
(4)反应Ⅲ中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=4mol.
(5)用硫酸控制体系的PH,若硫酸加入量过小,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动,不利于产物生成.
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)${\;}_{4}^{2+}$聚合离子,该水解反应的离子方程式是2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.

已知:部分阳离子以氢氧化物形式沉淀时溶剂的pH见表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(2)反应Ⅱ中加入NaHCO3调节体系PH在4.4≤pH<7.5 范围内.
(3)反应Ⅲ中生成的气体遇空气变红棕色,则反应Ⅲ中发生反应的离子方程式是2H++Fe2++NO2-=Fe3++NO↑+H2O.
(4)反应Ⅲ中通入氧气可减少NaNO2的用量,若消耗1mol氧气可节约n(NaNO2)=4mol.
(5)用硫酸控制体系的PH,若硫酸加入量过小,容易生成沉淀;若硫酸加入量过大,不利于产品形成,用化学平衡移动原理分析其原因是过量的硫酸与Fe(OH)SO4电离出来的OH-中和,使电离平衡向右移动,不利于产物生成.
(6)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)${\;}_{4}^{2+}$聚合离子,该水解反应的离子方程式是2[Fe(OH)]2++2H2O?[Fe2(OH)4]2++2H+.
6.电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法不正确的是( )
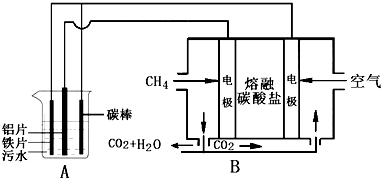

| A. | 装置B中通CH4一极电极反应为:CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 装置B中CO32-向CH4一极移动 | |
| C. | A中阳极相关反应有:Fe-2e-═Fe2+ 2H2O-4e-═4H++O2↑ 12Fe2++3O2+6H2O═4Fe(OH)3↓+8Fe3+ | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
13.五种短周期元素的某些性质如表所示,下列说法正确的是( )
| 元素代号 | X | W | Y | Z | Q |
| 原子半径(×10-12m) | 37 | 71 | 74 | 77 | 186 |
| 主要化合价 | +1 | -1 | -2 | +4、-4 | +1 |
| A. | X和Q都属于金属元素 | |
| B. | Y和Z的基态原子s能级和p能级电子数相同 | |
| C. | Y和W的第一电离能大小比较:Y>W | |
| D. | X、Z形成的化合物分子中可能既有σ键又有π键 |
3.下列有关的说法正确的是( )
| A. | 用活性炭除去冰箱中的异味是发生了化学反应 | |
| B. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 | |
| C. | 碘是人体必需微量元素,所以要多吃富含碘化钾的食物 | |
| D. | 可以利用氯化铁溶液的酸性清除铜镜表面的铜锈 |
10.常温常压下,下列物质为液态的是( )
| A. | 白银 | B. | 白磷 | C. | 乙烯 | D. | 水银 |
7.下列溶液中的溶质,不发生电离的是( )
| A. | 苏打水 | B. | 葡萄糖水 | C. | 稀盐酸 | D. | 生理盐水 |
1.从2011年3月16日下午开始,大陆“海水受日本核辐射污染,碘可防辐射”等消息疯传,从浙江沿海地区开始出现抢盐潮,接着蔓延到多个城市,人们抢购加碘盐是因为食盐中添加了碘元素.

Ⅰ.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为50mg/kg,要达到上述碘含量要求,需服用该碘盐2kg,你觉得服用碘盐防辐射合理吗?不合理
Ⅱ.如图1为某加碘盐标签的一部分.
已知:
①KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
②I2+2Na2S2O3═2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄
色,再加入3滴淀粉溶液.
步骤2:取一支50.00mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
(1)第一次读数为24.00mL.
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算此加碘盐碘元素的含量为$\frac{508000b}{a}$mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏高的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失.

Ⅰ.人们在即将受到核辐射前的24小时内,需在医生指导下服用碘片,成人推荐服用量为100mg碘,假设此碘盐碘元素含量为50mg/kg,要达到上述碘含量要求,需服用该碘盐2kg,你觉得服用碘盐防辐射合理吗?不合理
Ⅱ.如图1为某加碘盐标签的一部分.
已知:
①KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O
②I2+2Na2S2O3═2NaI+Na2S4O6(无色)
某同学欲测定此加碘盐中碘元素的含量,进行以下实验:
步骤1:称取ag市售食盐,配成溶液,全部转移至锥形瓶中,加入适量新制KI溶液,滴入几滴稀硫酸,溶液变黄
色,再加入3滴淀粉溶液.
步骤2:取一支50.00mL碱式滴定管,用bmol•L-1的新制Na2S2O3溶液润洗2~3次后,装满溶液,调节液面高度至0刻度.
步骤3:开始滴定直至终点,重复操作2~3次,实验数据记录如下:
| 编号 | 碱式滴定管读数 | 消耗体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 0 | 如图一 | |
| 2 | 0 | 23.97 | 23.97 |
| 3 | 0 | 24.03 | 24.03 |
(2)滴定终点的判断方法溶液颜色恰好由蓝色变为无色且半分钟内不褪色.
(3)经过计算此加碘盐碘元素的含量为$\frac{508000b}{a}$mg/kg(用包含a、b的最简表达式表示).
(4)下列操作可能会导致测量结果偏高的是CD.
A.步骤1中称取食盐时将砝码放在左盘,食盐放在放在右盘,游码读数为0.5g
B.步骤1所配食盐溶液未完全转移至锥形瓶
C.步骤2中滴定管洗涤后未润洗
D.步骤3滴定前滴定管尖嘴处有气泡,滴定后气泡消失.