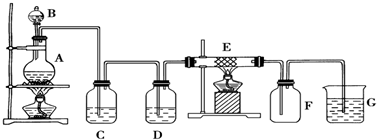
题目内容
20.某温度时,把1mol N2O4气体通入体积为10L的真空密闭容器中,立即出现红棕色[因为发生N2O4(无色)?2NO2(红棕色)的反应],反应进行4s时,NO2的浓度为0.04mol•L-1,再经过一段时间后 反应达到平衡状态,这时容器内压强为开始时的1.8倍,则(1)前4s以N2O4浓度变化表示的平均反应速率为0.005mol•L-1•s-1
(2)在4s末时容器内的压强是开始时的1.2倍
(3)平衡时容器内NO2的浓度是0.16 mol•L-1.
分析 (1)根据v=$\frac{△c}{△t}$计算二氧化氮的速率,再根据速率之比=计量数之比计算四氧化二氮的速率;
(2)根据n=cV计算4s时NO2的物质的量,结合方程式计算参加反应四氧化二氮的物质的量,进而计算4s时混合气体总物质的量,恒温恒容下,气体压强之比等于其物质的量之比;
(3)恒温恒容下,气体压强之比等于其物质的量之比,据此计算平衡时混合气体总物质的量,根据方程式利用差量法计算消耗的N2O4的物质的量,进而计算NO2的平衡浓度.
解答 解:(1)4s时NO2的浓度为0.04mol/L,则v(NO2)=$\frac{0.04mol/L}{4s}$=0.01mol•L-1•s-1,v(N2O4)=$\frac{1}{2}$×0.01mol•L-1•s-1=0.005mol•L-1•s-1;
故答案为:0.005 mol•L-1•s-1
(2)4s时NO2的物质的量为10L×0.04mol/L=0.4mol,则参加反应N2O4的物质的量为0.4mol×$\frac{1}{2}$=0.2mol,故4s时混合气体总物质的量为(1mol-0.2mol)+0.4mol=1.2mol,恒温恒容下,气体压强之比等于其物质的量之比,故4s时容器内的压强为开始时的$\frac{1.2mol}{1mol}$=1.2倍;
故答案为:1.2;
(3)恒温恒容下,气体压强之比等于其物质的量之比,则平衡时混合气体总物质的量为1mol×1.8=1.8mol,则:
N2O4?2NO2 △n
1mol 1mol
0.8mol←1.8mol-1mol=0.8mol
则参与反应的四氧化二氮为0.8mol,生成的N2O4为1.6mol,平衡时容器内NO2的浓度是$\frac{1.6mol}{10L}$=0.16 mol•L-1;
故答案为:0.16 mol•L-1.
点评 本题考查化学反应速率计算、化学平衡有关计算,基础性强,难度不大,有利于基础知识的巩固.注意计算准确.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | Cu+2FeCl3═CuCl2+2FeCl2 | |
| B. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | Cl2+2KI═2KCl+I2 | |
| D. | 2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑ |
| A. | 浊液a中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| B. | 滤液b中不含有Ag+ | |
| C. | ③中颜色变化说明AgCl转化为AgI | |
| D. | 实验可以证明AgI比AgCl更难溶 |
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率小于80% |
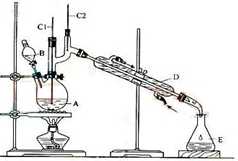 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.Na2Cr2O7H2SO4加热
发生的反应如下:
CH3CH2CH2CH2OH$\frac{\underline{\;\;\;Na_{2}Cr_{2}O_{7}\;\;\;}}{H_{2}SO_{4}加热}$ CH3CH2CH2CHO
反应物和产物的相关数据列表如表:
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90-95℃,在E中收集90℃以下的馏分.将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75-77℃馏分,产量2.4g.回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由不能,浓硫酸溶于水会放出大量热,容易溅出伤人.
(2)加入沸石的作用是防止液体暴沸.若加热后发现未加沸石,应采取的正确方法是冷却后补加.
(3)装置图中,D仪器的名称是滴液漏斗,B仪器的名称是直形冷凝管,冷水从下进.(填上或下)
(4)分液漏斗使用前必须进行的操作是b(填正确答案标号).
a.润湿 b.检漏 c.干燥 d.标定
(5)将正丁醛粗产品置于分液漏斗中分层时,水在下 层(填“上”或“下”)
(6)本实验中,正丁醛的产率为62.5%.
(7)反应温度应保持在90-95℃,其原因是保证正丁醛及时蒸出,又可尽量避免其被进一步氧化.
| A. | 纤维素 | B. | 淀粉 | C. | 葡萄糖 | D. | 蛋白质 |
 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.