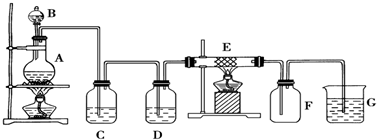
题目内容
10.下列说法正确的是( )| A. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| B. | Al在浓硫酸中会“钝化”能用铝槽盛放浓硫酸 | |
| C. | 四氯化碳常用作灭火剂 | |
| D. | 在碱性溶液中可以大量存在:S2O32-、AlO2-、SiO32-、S2-、Na+ |
分析 A.一氧化氮易被氧气氧化生成二氧化氮;
B.依据浓硫酸的强氧化性解答;
C.在一定条件下四氯化碳会产生窒息性的剧毒气体--光气;
D.依据离子反应条件判断.
解答 解:A.一氧化氮在空气中能够被氧气氧化,不能稳定存在,故A错误;
B.浓硫酸的强氧化性,常温下能够使铝钝化,可以用铝槽盛放浓硫酸,但是加热条件下能够与浓硫酸反应,故B错误;
C.由于在一定条件下四氯化碳会产生窒息性的剧毒气体--光气,不用于灭火,故C错误;
D.碱性溶液中存在大量氢氧根离子,S2O32-、AlO2-、SiO32-、S2-、Na+离子之间不反应,且都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选:D.
点评 本题考查了元素化合物知识,离子的共存,明确相关物质的性质是解题关键,注意离子反应的条件,题目难度不大.

练习册系列答案
相关题目
1.一定条件下,将TiO2和焦炭放入密闭真空容器中,反应TiO2(s)+C(s)?Ti(s)+CO2 (g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法一定正确的是( )
| A. | 平衡常数减小 | B. | TiO2的质量不变 | C. | CO2的浓度不变 | D. | Ti的质量增加 |
18.用石墨作电极,电解1mol•L-1下列物质的溶液,通电一段时间后溶液的pH升高的是( )
| A. | H2 SO4 | B. | CuSO4 | C. | Na2 SO4 | D. | NaCl |
5.下列化学反应既属于氧化还原反应又属于四种基本反应类型的是( )
| A. | Cu+2FeCl3═CuCl2+2FeCl2 | |
| B. | 2NaHCO3 $\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑ | |
| C. | Cl2+2KI═2KCl+I2 | |
| D. | 2CuSO4+2H2O $\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑ |
15.下列实验操作中错误的是( )
| A. | 用量筒量取12.12mL的盐酸 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称量时,称量物应放在托盘天平的左盘,砝码放在托盘天平的右盘中 |
2.下列离子反应方程式正确的是( )
| A. | 将铜插入硝酸银溶液中:Cu+Ag+═Cu2++Ag | |
| B. | Ca( HCO3)2 溶液与过量 NaOH 溶液反应:HCO3-+OH-+Ca2+═CaCO3↓+H2O | |
| C. | 用食醋除水垢:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | 稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba 2++OH-═BaSO 4↓+H2O |
4.利用工厂的废铁屑(含少量Fe2O3、SiO2、锡等),制备绿矾(FeSO4•7H2O)的过程如下:
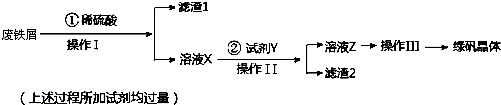
已知:①室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
②溶液X加KSCN不显红色.
(1)操作I的名称为过滤,所需玻璃仪器为烧杯、漏斗、玻璃棒.
(2)操作III的顺序依次为:加热蒸发、冷却结晶、过滤、洗涤、干燥.
(3)操作 II 中,试剂 Y 是H2S,然后用稀硫酸将溶液酸化至 pH=2 的目的是除去溶液中的Sn2+离子,并防止Fe2+离子生成沉淀.
(4)写出绿矾与酸性高锰酸钾溶液反应的离子方程式MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(5)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至 pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
上述实验①②③所用氢氧化钠均不含杂质,且实验数据可靠.通过计算,分析和比较上表3组数据,给出结论.

已知:①室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
②溶液X加KSCN不显红色.
(1)操作I的名称为过滤,所需玻璃仪器为烧杯、漏斗、玻璃棒.
(2)操作III的顺序依次为:加热蒸发、冷却结晶、过滤、洗涤、干燥.
(3)操作 II 中,试剂 Y 是H2S,然后用稀硫酸将溶液酸化至 pH=2 的目的是除去溶液中的Sn2+离子,并防止Fe2+离子生成沉淀.
(4)写出绿矾与酸性高锰酸钾溶液反应的离子方程式MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O.
(5)常温下,称取不同氢氧化钠样品溶于水,加盐酸中和至 pH=7,然后将溶液蒸干得氯化钠晶体,蒸干过程中产品无损失.
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
 ;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.
;反应中1mol氧化剂得到 (填“得到”或“失去”)6mol电子.