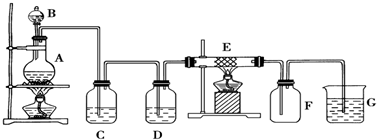
题目内容
10.900℃时,向2.0L恒容密闭容器中充入0.40mol乙苯,发生反应: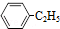 (g)?
(g)?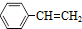 (g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:
(g)+H2(g)△H=akJ•mol-1,经一段时间后达到平衡,反应过程中测定的部分数据见表:| 时间/min | 0 | 10 | 20 | 30 | 40 |
| n(乙苯)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
| n(苯乙烯)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
| A. | 反应在前20min的平均速率为v(H2)=0.008mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(乙苯)=0.08 mol•L-1,则a<0 | |
| C. | 保持其他条件不变,平衡后向容器中再充入0.40mol乙苯,再次达到平衡时乙苯的转化率小于50.0% | |
| D. | 相同温度下,起始时向容器中充入0.10 mol乙苯、0.10 mol苯乙烯和0.30 molH2,达到平衡前v(正)>v(逆) |
分析 A.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,根据v=$\frac{△c}{△t}$计算v(乙苯),再根据速率之比等于化学计量数之比计算v(H2);
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,计算平衡时乙苯的浓度,根据升高温度乙苯的浓度变化,再判断温度对平衡的影响;
C.保持其他条件不变,平衡后向容器中再充入0.40mol乙苯,反应体积增大,相当于加压,逆向移动;
D.利用三段式平衡时各组分的平衡浓度,计算平衡常数,计算此时的浓度商Qc,与平衡常数比较,判断反应进行方向,据此解答.
解答 解:A.由表中数据可知,20min内乙苯的物质的量变化量为0.4mol-0.24mol=0.16mol,故v(乙苯)=$\frac{0.16mol÷2L}{20min}$=0.004mol•L-1•min-1,速率之比等于化学计量数之比,则v(H2)=v(乙苯)=0.004mol•L-1•min-1,故A错误;
B.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为$\frac{0.4mol-0.2mol}{2L}$=0.1mol/L,升高温度乙苯的浓度变为0.08mol•L-1,说明平衡向正反应移动,正反应为吸热反应,故a>0,故B错误;
由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,由方程式可知,参加反应的乙苯的物质的量为0.2mol,故乙苯的转化率为$\frac{0.2mol}{0.4mol}$×100%=50%,保持其他条件不变,平衡后向容器中再充入0.40mol乙苯,相当于在原平衡加压,该反应体积增大,加压平衡逆向移动,所以乙苯的转化率减小,故C正确;
D.由表中数据可知,30min时处于平衡状态,平衡时苯乙烯的物质的量为0.2mol,平衡时苯乙烯的浓度为0.1mol/L,由方程式可知,氢气的平衡浓度为0.1mol/L,参加反应的乙苯的物质的量为0.2mol,故平衡时乙苯的浓度为0.1mol/L,故平衡常数k=$\frac{0.1×0.1}{0.1}$=0.1,相同温度下,起始时向容器中充入0.10mol乙苯、0.10mol苯乙烯和0.30molH2,此时浓度商Qc=$\frac{(0.1÷2)•(0.3÷2)}{(0.1÷2)}$=0.15,大于平衡常数0.1,反应向逆反应进行,故达到平衡前v正<v逆,故D错误;
故选C.
点评 本题考查化学反应速率计算、化学平衡有关计算、化学平衡常数计算与应用,难度中等,注意D选项中利用平衡常数判断反应进行方向.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 用量筒量取12.12mL的盐酸 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 称量时,称量物应放在托盘天平的左盘,砝码放在托盘天平的右盘中 |
| A. | 1﹕2﹕3 | B. | 1﹕1﹕1 | C. | 2﹕3﹕6 | D. | 3﹕2﹕1 |
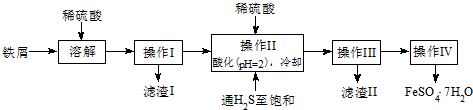
查询资料,得有关物质的数据如表:
| 25℃时 | pH值 |
| 饱和H2S溶液 | 3.9 |
| SnS沉淀完全 | 1.6 |
| FeS开始沉淀 | 3.0 |
| FeS沉淀完全 | 5.5 |
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是除去溶液中的Sn2+离子,并防止Fe2+被氧化.
(3)操作IV的顺序依次为蒸发浓缩、冷却结晶、过滤.
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4•7H2O的损耗.
(5)测定绿矾产品中Fe2+含量的方法是:
a.称取一定量的绿矾产品,溶解,在250mL容量瓶中定容;b.量取一定量的待测溶液于锥形瓶中;c.再用硫酸酸化的KMnO4溶液滴定至终点.
①滴定时盛放KMnO4溶液的仪器为酸式滴定管(填仪器名称).
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色.
| A. | 2倍 | B. | 1.5倍 | C. | 0.9倍 | D. | 0.5倍 |
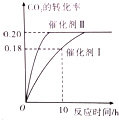 已知CO2可生成绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃时密闭容器中,当c(CO2)=1.00mol/L、c(H2)=1.60mol/L开始反应,结果如图所示,回答下列问题:
已知CO2可生成绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃时密闭容器中,当c(CO2)=1.00mol/L、c(H2)=1.60mol/L开始反应,结果如图所示,回答下列问题: