题目内容
15.下列物质的电子式错误的是( )| A. | 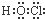 | B. | 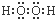 | C. | 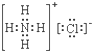 | D. | 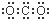 |
分析 A、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键;
B、双氧水中两个氢原子分别与两个氧原子通过共用一对电子结合,两个氧原子之间通过共用1对电子结合;
C、氯化铵为离子化合物,由铵根离子和氯离子构成;
D、二氧化碳中存在两个碳氧双键,C、O原子最外层都达到最外层8个电子;
解答 解:A、HClO为共价化合物,分子中存在1个氧氢键和1个Cl-O键,次氯酸的电子式为: ,故A正确;
,故A正确;
B、双氧水为共价化合物,分子中存在两个氧氢键和一个O-O键,双氧水的电子式为: ,故B正确;
,故B正确;
C、氯化铵为离子化合物,由铵根离子和氯离子构成,故电子式为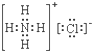 ,故C正确;
,故C正确;
D、二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为: ,故D错误.
,故D错误.
故选D.
点评 本题考查了电子式的书写,题目难度不大,注意掌握电子式的概念及书写原则,明确离子化合物与共价化合物的电子式表示方法及区别.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.设NA是阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4L乙醇中含有的氧原子数为NA | |
| B. | 64g的S2和S8混合物中,含硫原子总数为2 NA | |
| C. | 1L 1mol/L氯化铁溶液中,含有NA个Fe3+ | |
| D. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-数目为2NA |
3.下列物质的类别与所含能团都正确的是( )
(1) 酚类-OH
酚类-OH
(2) 羧酸-COOH--
羧酸-COOH--
(3) 醛类
醛类
(4)CH3-O-CH3醚类
(5 酯类
酯类
(1)
 酚类-OH
酚类-OH(2)
 羧酸-COOH--
羧酸-COOH--(3)
 醛类
醛类
(4)CH3-O-CH3醚类

(5
 酯类
酯类
| A. | (1)(2)(3)(4)(5) | B. | (2)(4) | C. | (2)(3)(4) | D. | (2)(4)(5) |
7.某同学按如图所示的装置进行电解实验.下列说法正确的是( )
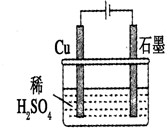

| A. | 石墨是电解池的负极,Cu是电解池的正极 | |
| B. | 电解过程中,铜电极上自身没什么变化 | |
| C. | 电解一定时间后,石墨电极上会有铜析出 | |
| D. | 整个电解过程中,溶液的pH不会变化 |
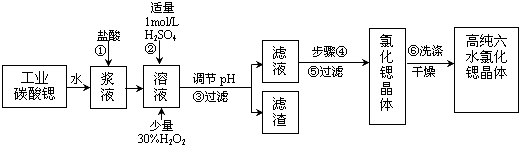
17.工业上用难溶于水的碳酸锶(SrCO3)粉末为原料(含少量钡和铁的化合物)制备高纯六水氯化锶晶体(SrCl2•6H2O),其过程为:
已知:Ⅰ.有关氢氧化物沉淀的pH:
Ⅱ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
(1)操作①中碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7
D氨水 E氢氧化锶粉末 F碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是A.
A.50~60℃B.80~100℃C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.

已知:Ⅰ.有关氢氧化物沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(1)操作①中碳酸锶与盐酸反应的离子方程式SrCO3+2H+=Sr2++CO2↑+H2O.
(2)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为E.
A.1.5 B.3.7 C.9.7
D氨水 E氢氧化锶粉末 F碳酸钠晶体
(3)操作②中加入H2O2发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用热风吹干六水氯化锶,适宜的温度是A.
A.50~60℃B.80~100℃C.100℃以上
(6)步骤⑥宜选用的无机洗涤剂是饱和氯化锶溶液.
 ;
;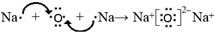 ;
;
 .
.