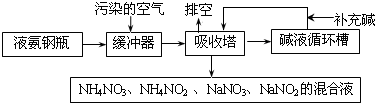
题目内容
20.水合肼(N2H4•H2O)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛.
(1)目前正在研发的高能量密度燃料电池车是以水合肼燃料电池作为动力来源,电池结构如图1所示.
①起始时正极区与负极区NaOH溶液浓度相同,工作一段时间后,NaOH浓度较大的是正(填“正”或“负”)极区.
②该电池负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑.
(2)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),0.1mol•L-1水合肼溶液中四种离子:①H+、②OH-、③N2H5+、④N2H62+的浓度从大到小的顺序为②③④①(填序号).
(3)在弱酸性条件下水合肼可处理电镀废水,将Cr2O72-还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为2Cr2O72-+4H++3N2H4•H2O=4Cr(OH)3↓+3N2+5H2O.
(4)肼是一种优良的贮氢材料,其在不同条件下分解方式不同.
①在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2物质的量变化如图2所示,该分解反应方程式为7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2.
②在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g).在1L密闭容器中加入0.1mol N2H4,测得容器中$\frac{n({H}_{2})+n({N}_{2})}{n(N{{\;}_{2}H}_{4})}$与时间关系如图3所示.则0~4min氮气的平均速率v(N2)=0.0125mol•L-1•min-1.
(5)碳酰肼(分子式:CH6N4O)是由DEC(酯)与N2H4发生取代反应得到,已知DEC的分子式为C5H10O3,DEC的核磁共振氢谱如图4所示,则DEC的结构简式为
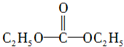 .
.
分析 (1)①正极是氧气得电子生成氢氧化根离子,所以正极区NaOH浓度较大;②负极发生氧化反应;
(2)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),两步电离都电离产生氢氧根离子,而第一步电离为主;
(3)根据得失电子守恒配平,其中的水合肼是弱电解质用化学式;
(4)①在高温下,N2H4可完全分解为NH3、N2及H2,所以分解反应方程式为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2;
②在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为:2xmol,此时N2H4(l)的物质的量为(1-x)mol,根据4min时比值为3,求出x的值,然后根v=$\frac{△c}{△t}$计算;
(5)C5H10O3分子中有两种氢,且不饱和度为1,所以碳氧双键高度对称.
解答 解:(1)①正极是氧气得电子发生还原反应,正极反应为:O2+2H2O+4e-=4OH-,生成氢氧化根离子,所以正极区NaOH浓度较大,故答案为:正;
②负极发生氧化反应,肼失电子和氢氧根离子反应生成氮气和水,电极反应式为N2H4+4OH--4e-=4H2O+N2↑,故答案为:N2H4+4OH--4e-=4H2O+N2↑;
(2)已知水合肼是二元弱碱(25℃,K1=5×10-7,K2=5×10-15),两步电离都电离产生氢氧根离子,而第一步电离为主,所以离子的浓度大小为:②OH-、③N2H5+、④N2H52+、①H+,故答案为:②③④①;
(3)根据得失电子守恒配平,其中的水合肼是弱电解质用化学式,所以离子方程式为:2Cr2O72-+4H++3N2H4•H2O=4Cr(OH)3↓+3N2+5H2O,
故答案为:2Cr2O72-+4H++3N2H4•H2O=4Cr(OH)3↓+3N2+5H2O;
(4)①在高温下,N2H4可完全分解为NH3、N2及H2,所以分解反应方程式为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2,故答案为:7N2H4$\frac{\underline{\;高温\;}}{\;}$8NH3+3N2+2H2;
②在303K,NiPt催化下,则发生N2H4(l)?N2(g)+2H2(g),设生成氮气的量为xmol,则氢气的量为:2xmol,此时N2H4(l)的物质的量为(0.1-x)mol,根据4min时比值为3,所以$\frac{3x}{0.1-x}$=3,则x=0.05mol,v=$\frac{△c}{△t}$=$\frac{0.05mol}{1L×4min}$=0.0125mol•L-1•min-1,故答案为:0.0125mol•L-1•min-1;
(5)C5H10O3分子中有两种氢,且不饱和度为1,所以碳氧双键高度对称,所以结构式为: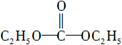 ,故答案为:
,故答案为: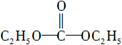 .
.
点评 本题考查电极反应式的书写、离子浓度大小的比较、离子方程式的书写、图象问题等,综合性强,但有一定的难度.

| A. | CO2 | B. | 水 | ||
| C. | 干沙 | D. | 干粉(含NaHCO3)灭火剂 |
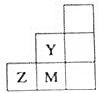
| A. | 非金属性:Y>Z>M | |
| B. | 离子半径:M->Z2->Y- | |
| C. | Z元素存在同素异形现象 | |
| D. | 三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
| A. | 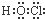 | B. | 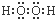 | C. | 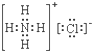 | D. | 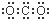 |
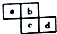
| A. | 原子半径:c>d>a>b | |
| B. | 原子序数d可能是a的3倍 | |
| C. | 最高价含氧酸的酸性c可能比d强 | |
| D. | 四种元素的氢化物可能是18电子分子 |
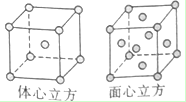 X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题:
X、Y、Z、W为前四周期元素且原子序数依次增大,X的电子层数等于核外电子数,Y元素基态原子核外未成对电子数为2且X与Y形成的化合物在常温下为常见的液体R,Z元素原子最外电子层上s、p电子数相等,W基态原子3d轨道的电子数是4s轨道电子数的3倍.请回答下列问题: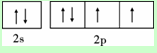 ,其第一电离能在同周期元素中由大到小排第4 位.
,其第一电离能在同周期元素中由大到小排第4 位.