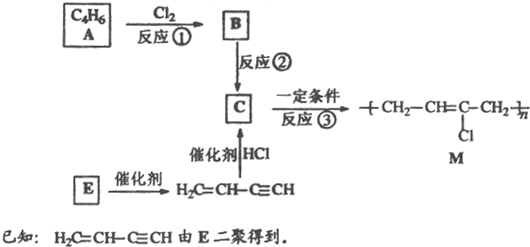
题目内容
(1)有以下几种物质 ①乙醇 ②醋酸铵 ③水 ④SO3⑤食盐水 ⑥BaSO4⑦液态氯化氢请填空回答(填序号).属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是 .
(2)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的小苏打(NaHCO3),能治疗胃酸过多,其反应的离子方程式为 .
(3)用高锰酸钾氧化密度为1.19g/cm3,质量分数为36.5%的浓盐酸.反应如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应的氧化产物为 ;当有15.8gKMnO4参加反应,被氧化的HCl的物质的量为 mol;反应中转移的电子总数为 ;将所得氯气与过量的石灰乳反应,则理论上最多可制得 g漂白粉.
(2)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的小苏打(NaHCO3),能治疗胃酸过多,其反应的离子方程式为
(3)用高锰酸钾氧化密度为1.19g/cm3,质量分数为36.5%的浓盐酸.反应如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,该反应的氧化产物为
考点:电解质与非电解质,氧化还原反应,钠的重要化合物
专题:氧化还原反应专题,电离平衡与溶液的pH专题,元素及其化合物
分析:(1)溶液中完全电离的电解质为强电解质,溶液中只能部分电离的电解质为弱电解质;在水溶液和熔融状态下都不能导电的化合物为非电解质,据此进行解答;
(2)苏打为NaHCO3,胃酸中含盐酸,二者反应生成氯化钠、水、二氧化碳;
(3)根据化合价变化判断氧化产物;根据16molHCl参加反应时,有10molHCl被氧化计算出被氧化的氯化氢的物质的量;根据化合价变化计算出转移的电子总数;根据氯气的物质的量计算出获得漂白粉的质量.
(2)苏打为NaHCO3,胃酸中含盐酸,二者反应生成氯化钠、水、二氧化碳;
(3)根据化合价变化判断氧化产物;根据16molHCl参加反应时,有10molHCl被氧化计算出被氧化的氯化氢的物质的量;根据化合价变化计算出转移的电子总数;根据氯气的物质的量计算出获得漂白粉的质量.
解答:
解:(1)强电解质在水溶液中能够完全电离,满足该条件下的为:②醋酸铵⑥BaSO4⑦液态氯化氢;
弱电解质在水溶液中只能部分电离,存在电离平衡,满足该条件的为:③水;
非电解质在水溶液和熔融状态下都不能导电,满足该条件的为:①乙醇 ④SO3,
故答案为:②⑥⑦;③;①④;
(2)小苏打为NaHCO3,胃酸中含盐酸,用小苏打治疗胃酸过多的离子反应为H++HCO3-=H2O+CO2↑,
故答案为:H++HCO3-=H2O+CO2↑;
(3)反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,氯化氢被氧化成氯气,所以氧化产物为Cl2;
n(KMnO4)=
=0.1mol,
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 被氧化的HCl
2mol 5mol 10mol
0.1mol n(Cl2) n(HCl)被氧化
则:n(HCl)被氧化=
=0.5mol;
反应被氧化0.5mol氯化氢会生成0.25mol氯气,反应转移了0.5mol电子,反应中转移的电子总数为0.5 NA;
0.25氯气通入足量石灰乳中发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;0.25molCl2完全反应生成次氯酸钙、氯化钙的物质的量都是0.125mol,则理论上生成漂白粉的质量为:0.125mol×143g/mol+111g/mol×0.25mol=31.75g;
故答案为:Cl2;0.5 mol;0.5 NA;31.75.
弱电解质在水溶液中只能部分电离,存在电离平衡,满足该条件的为:③水;
非电解质在水溶液和熔融状态下都不能导电,满足该条件的为:①乙醇 ④SO3,
故答案为:②⑥⑦;③;①④;
(2)小苏打为NaHCO3,胃酸中含盐酸,用小苏打治疗胃酸过多的离子反应为H++HCO3-=H2O+CO2↑,
故答案为:H++HCO3-=H2O+CO2↑;
(3)反应2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O中,氯化氢被氧化成氯气,所以氧化产物为Cl2;
n(KMnO4)=
| 15.8g |
| 158g/mol |
2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O 被氧化的HCl
2mol 5mol 10mol
0.1mol n(Cl2) n(HCl)被氧化
则:n(HCl)被氧化=
| 10mol×0.1mol |
| 2mol |
反应被氧化0.5mol氯化氢会生成0.25mol氯气,反应转移了0.5mol电子,反应中转移的电子总数为0.5 NA;
0.25氯气通入足量石灰乳中发生反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;0.25molCl2完全反应生成次氯酸钙、氯化钙的物质的量都是0.125mol,则理论上生成漂白粉的质量为:0.125mol×143g/mol+111g/mol×0.25mol=31.75g;
故答案为:Cl2;0.5 mol;0.5 NA;31.75.
点评:本题考查了电解质与非电解质、强电解质与弱电解质的判断、氧化还原反应的计算等知识,题目难度中等,试题涉及的题量较大,知识点较多,充分考查了学生对所学知识的掌握情况.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
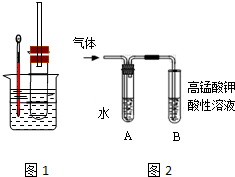 用图1实验装置(铁架台、酒精灯略) 验证溴乙烷的性质:
用图1实验装置(铁架台、酒精灯略) 验证溴乙烷的性质: