题目内容
(1)某温度下,纯水中c(H+ )=5.0×10-7 mol/L,则此时纯水中的c(OH-)= ;若温度不变,在0.01mol/L稀硫酸溶液中,c(OH-)= .
(2)25℃时,将pH=12NaOH溶液与pH=2的H2SO4溶液混合后pH=11(忽略混合后体积的变化),则NaOH溶液与H2SO4溶液的体积比为 .
(3)25℃时,将0.1mol/L NaOH溶液与0.06mol/L的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH= .
(2)25℃时,将pH=12NaOH溶液与pH=2的H2SO4溶液混合后pH=11(忽略混合后体积的变化),则NaOH溶液与H2SO4溶液的体积比为
(3)25℃时,将0.1mol/L NaOH溶液与0.06mol/L的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH=
考点:离子积常数,酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:(1)纯水中水电离出的氢离子和氢氧根离子浓度是相等的;根据溶液中,Kw=C(H+)?c(OH-)来计算酸溶液中氢氧根离子浓度;
(2)混合溶液pH=11,则混合溶液中c(OH-)=10-3mol/L,据此计算酸碱体积之比;
(3)根据酸的量和碱的量判断二者混合后酸剩余,计算混合后剩余氢离子浓度,进而计算pH即可.
(2)混合溶液pH=11,则混合溶液中c(OH-)=10-3mol/L,据此计算酸碱体积之比;
(3)根据酸的量和碱的量判断二者混合后酸剩余,计算混合后剩余氢离子浓度,进而计算pH即可.
解答:
解:(1)纯水中水电离出的氢离子和氢氧根离子浓度是相等的,所以纯水中c(H+ )=5.0×10-7 mol/L=c(OH-),此温度下Kw=2.5×10-13mol2/L2,溶液中,Kw=c(H+)?c(OH-),所以0.01mol/L稀硫酸溶液中,c(OH-)=
=
=1.25×10-11mol/L,故答案为:5.0×10-7 mol/L;1.25×10-11mol/L;
(2)将pH=12NaOH溶液与pH=2的H2SO4溶液混合后pH=11(忽略混合后体积的变化),设NaOH溶液与H2SO4溶液的体积分别为X、Y,则
=10-3,解得X:Y=11:9,故答案为:11:9;
(3)设两溶液体积是V,0.1mol/L NaOH溶液中氢氧根离子物质的量是0.1V,0.06mol/L的H2SO4溶液的物质的量是0.12V,混合后酸剩余,所以剩余氢离子浓度c=
=0.01mol/L,即pH=2,故答案为:2.
| Kw |
| c(H+) |
| 2.5×10-13 |
| 0.02 |
(2)将pH=12NaOH溶液与pH=2的H2SO4溶液混合后pH=11(忽略混合后体积的变化),设NaOH溶液与H2SO4溶液的体积分别为X、Y,则
| 10-2X-10-2Y |
| X+Y |
(3)设两溶液体积是V,0.1mol/L NaOH溶液中氢氧根离子物质的量是0.1V,0.06mol/L的H2SO4溶液的物质的量是0.12V,混合后酸剩余,所以剩余氢离子浓度c=
| 0.12V-0.1V |
| 2V |
点评:本题涉及水的离子积常数的意义以及酸碱混合后溶液pH的计算知识,属于综合知识的考查,难度中等.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
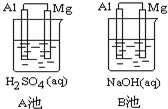 Al-Mg在不同的电解质溶液中分别构成原电池A、B.如图所示:
Al-Mg在不同的电解质溶液中分别构成原电池A、B.如图所示: 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2,则线段BC表示
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,已知:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2,则线段BC表示