题目内容
1.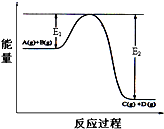 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.(1)该反应是放热反应(填“吸热”或“放热”);反应热△H=E1-E2;(用E1、E2表示)
(2)反应体系中加入催化剂对反应热是否有影响?无影响,原因是催化剂不改变反应物总能量与生成物总能量,故反应热不变;
(3)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1减小,E2减小(填“增大”、“减小”或“不变”).
分析 (1)根据反应物与生成物总能量大小判断反应吸放热,反应热△H=反应物的活化能-生成物的活化能;
(2)加入催化剂能降低反应的活化能,催化剂不改变反应物总能量与生成物总能量之差即反应热不变;
(3)加入催化剂能降低反应的活化能.
解答 解:(1)由图象可知该反应是一个能量降低的反应,所以属于放热反应;反应热△H=反应物的活化能-生成物的活化能=E1-E2;
故答案为:放热;E1-E2;
(2)催化剂的使用能降低正逆反应的活化能,但催化剂不改变反应物总能量与生成物总能量,故反应热不变,所以E的大小对该反应的反应热无影响;
故答案为:无影响;催化剂不改变反应物总能量与生成物总能量,故反应热不变;
(3)加入催化剂改变了反应的途径,降低反应所需的活化能,所以E1和E2均减小,故答案为:减小;减小.
点评 本题考查反应热的判断,影响化学反应速率和平衡的因素,难度适中,注意催化剂对活化能和反应热的影响.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
12.某强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、Fe3+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是( )

下列结论正确的是( )
| A. | X中不能确定的离子是Fe3+、A13+、K+、Na+和C1- | |
| B. | 沉淀G中加入盐酸溶解,滴加KSCN溶液显红色,可以确定原溶液中有Fe3+ | |
| C. | 溶液J焰色反应显黄色,则说明原溶液中存在Na+ | |
| D. | 沉淀I一定是A1(OH)3 |
9.下列装置或操作能达到相应实验目的是( )
| A. |  制备少量氨气 | B. |  海带灼烧成灰 | ||
| C. |  分液时取出下层液体 | D. |  检查气密性 |
6.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,在NH4Cl溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
13.已知:①能量越低的物质越稳定,②白磷转化成红磷放出热量.据此,下列判断或说法中正确的是( )
| A. | 在相同的条件下,白磷比红磷稳定 | |
| B. | 红磷容易发生自燃而白磷则不会 | |
| C. | 红磷和白磷的结构相同 | |
| D. | 自在相同的条件下,红磷比白磷稳定 |
10.下列叙述不正确的是( )
| A. | 0.1 mol•L-1氨水中,c(OH-)>c(NH4+) | |
| B. | 等体积等物质的量浓度的NaX和弱酸HX混合后的溶液中:c(Na+)>c(HX)>c(X-)>c(H+)>c(OH-) | |
| C. | 在0.1 mol•L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+) | |
| D. | 0.1 mol•L-1某二元弱酸强碱盐Na2A溶液中,c(Na+)=2c(A2-)+2c(HA-)+2c(H2A) |
 (1)实验室用NaNO3固体配制500mL 0.40mol/L NaNO3溶液.
(1)实验室用NaNO3固体配制500mL 0.40mol/L NaNO3溶液.