题目内容
5.将等物质的量浓度的CuSO4和NaCl溶液等体积混合后,用石墨电极进行电解,电解过程中溶液pH随时间t变化的曲线正确的是(不考虑Cl2的溶解)( )| A. | 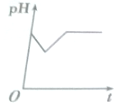 | B. | 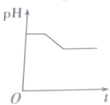 | C. | 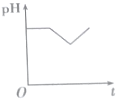 | D. | 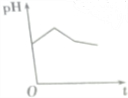 |
分析 用惰性电极电解等物质的量浓度、等体积的CuSO4和NaCl混合溶液,则二者物质的量相等,假设都是1mol,阴极离子放电顺序是Cu2+、H+,阳极上离子放电顺序是Cl-、OH-,
电解过程中分三段:
第一阶段:阳极上电极反应式为2Cl--2e-═Cl2↑、阴极电极反应式为Cu2++2e-═Cu,当转移1mol电子时为止;
第二阶段:阳极上电极反应式为4OH--4e-═2H2O+O2↑,阴极反应先发生Cu2++2e-═Cu,转移1mol电子为止;
第三阶段:阳极电极反应式为4OH--4e-═2H2O+O2↑、阴极电极反应式为2H++2e-═H2↑,据此判断溶液pH变化.
解答 解:用惰性电极电解等物质的量浓度、等体积的CuSO4和NaCl混合溶液,则二者物质的量相等,假设都是1mol,阴极离子放电顺序是Cu2+、H+,阳极上离子放电顺序是Cl-、OH-,
电解过程中分三段:
第一阶段:阳极上电极反应式为2Cl--2e-═Cl2↑、阴极电极反应式为Cu2++2e-═Cu,当转移1mol电子时为止,该过程中相当于电解氯化铜溶液,氯化铜是强酸弱碱盐,其水溶液呈酸性,氯化铜浓度越小,其溶液的pH越大,所以该阶段溶液的pH增大;
第二阶段:阳极上电极反应式为4OH--4e-═2H2O+O2↑,阴极反应先发生Cu2++2e-═Cu,转移1mol电子为止,该阶段溶液中氢离子浓度大于氢氧根离子浓度,导致溶液酸性增强,溶液的pH降低;
第三阶段:阳极电极反应式为4OH--4e-═2H2O+O2↑、阴极电极反应式为2H++2e-═H2↑,据此判断溶液pH变化,该阶段相当于电解水,导致溶液中氢离子浓度逐渐增大,pH值减小,
故选D.
点评 本题考查电解原理,为高频考点,明确离子放电顺序是解本题关键,熟悉电解过程中溶液中氢离子浓度变化,易错点是第三阶段氢离子浓度变化,题目难度不大.

| A. | 2NO2(g)?N2O4(g),升温时体系颜色加深说明正反应为吸热反应 | |
| B. | N2(g)+3H2(g)?2NH3(g),若升温时NH3的浓度减小,则平衡常数K增大 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g),升温时CO的转化率增大,说明正反应为吸热反应 | |
| D. | 反应2HI(g)?H2(g)+I2(g)达到平衡后,增大HI的物质的量,平衡不移动 |
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | 可用超纯硅制造的单晶硅来制造计算机的芯片 | |
| C. | 实验室用二氧化锰和浓盐酸共热制取少量氯气 | |
| D. | 氢氧化钠溶液要盛放在磨口玻璃塞的试剂瓶里 |
| A. | BaCl2溶液与Na2S03溶液加足量稀HNO3 | |
| B. | Ba(0H)2溶液与KN03溶液加足量稀H2SO4 | |
| C. | AgN03溶液与Na2C03溶液加足量稀盐酸 | |
| D. | Ca(0H)2溶液与FeCl3溶液加足量稀HNO3 |
| A. | Na+、K+、S2-、Cl- | B. | Al3+、Mg2+、SO42-、Cl- | ||
| C. | K+、Na+、SiO32-、NO3- | D. | K+、Na+、SO42-、CO32- |

 C6H14
C6H14 C5H12
C5H12 C7H14
C7H14 C10H8.
C10H8.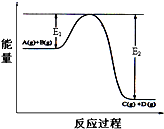 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,回答下列问题.