题目内容
14.200mL盐酸和100mL含有0.20mol碳酸钠的溶液,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )| A. | 2.0mol/L | B. | 1.5 mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
分析 当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,当盐酸滴入碳酸钠溶液时,发生反应为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,根据二者之间的关系式来分析解答.
解答 解:当碳酸钠滴入盐酸中时发生CO32-+2H+═H2O+CO2↑,当盐酸滴入碳酸钠溶液时,反应顺序为CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,
所以1<n(HCl):n(Na2CO3)<2,n(Na2CO3)=0.20mol,则0.2mol<n(HCl)<0.4mol,盐酸的体积是200mL,所以$\frac{0.2mol}{0.2L}$<c(HCl)<$\frac{0.4mol}{0.2L}$,即1mol/L<c(HCl)<2mol/L,
故选B.
点评 本题考查化学方程式的有关计算,明确二者滴定顺序不同其反应方程式不同是解本题关键,再根据题意结合反应方程式进行计算,难度中等.

练习册系列答案
相关题目
8.化学实验中安全意识是重要的科学素养,下列实验操作或事故处理操作中正确的是( )
| A. | 酒精灯不慎碰倒起火时可用水扑灭 | |
| B. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| C. | 配制硫酸溶液时,可先在量筒中加入一定量的水,再在搅拌条件下加入浓硫酸 | |
| D. | 做“氢气还原氧化铜”的实验时,先加热再通氢气 |
5.在无色溶液里能大量共存,但加入盐酸后不能大量共存的离子组是( )
| A. | Fe3+、K+、Ag+、NO3-、 | B. | Na+、K+、CO32-、C1- | ||
| C. | NH4+、Al3+、Cl-、NO3- | D. | Mg2+、Na+、CO32-、SO42- |
19.已知下列热化学方程式:Zn(s)+$\frac{1}{2}$O2( )=ZnO(s);△H=-351.1kJ/mol
Hg(l)+$\frac{1}{2}$O2(g)=HgO(s);△H=-90.7kJ/mol,
由此可知反应:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
Hg(l)+$\frac{1}{2}$O2(g)=HgO(s);△H=-90.7kJ/mol,
由此可知反应:Zn(s)+HgO(s)=ZnO(s)+Hg(l)的△H为( )
| A. | △H=-1141.8kJ/mol | B. | △H=+260.4kJ/mol | ||
| C. | △H=+441.8kJ/mol | D. | △H=-260.4kJ/mol |
3.铀元素的一种原子${\;}_{92}^{235}U$,可作为核反应堆的燃料,该原子的中子数为( )
| A. | 92 | B. | 143 | C. | 235 | D. | 327 |
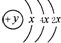 ,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.
,B、C可形成离子化合物B3C2,B离子与C离子具有相同的电子层结构,D的气态氢化物H2D的还原性较强.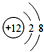 .
.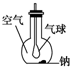 如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.
如图所示装置,在平底烧瓶的底部有一块钠,平底烧瓶内是干燥的空气.过一段时间后可观察到钠表面变暗,气球膨胀,发生反应的化学方程式为4Na+O2═2Na2O.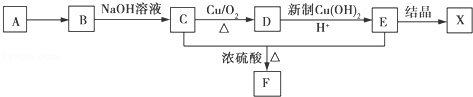
 .
.