题目内容
16.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压下,16 g O3中含有质子总数为8NA | |
| B. | 25℃时,1 mL纯水中含有OH-离子数目为10-10 | |
| C. | pH=2的醋酸稀释10倍后,溶液中H+数目大于0.001NA | |
| D. | 1molCl2与足量NaOH溶液反应,转移的电子数为2NA |
分析 A.质量转化为物质的量结合1个氧原子含有8个质子解答;
B.25℃时水中氢离子和氢氧根离子的浓度为10-7mol/L;
C.溶液体积未知;
D.1molCl2与NaOH溶液的反应为歧化反应.
解答 解:A.常温常压下,16 g O3中含有质子总数为$\frac{16g}{16g/mol}$×8×NA=8NA,故A正确;
B.25℃时水的离子积为10-14,水中氢离子和氢氧根离子的浓度为10-7mol/L,所以1 mL纯水中含有物质的量=浓度×体积,10-7×10-3=10-10NA个OH-离子,故B正确;
C.溶液体积未知,无法计算氢离子个数,故C错误;
D.氯气与NaOH溶液的反应为歧化反应,1molCl2转移1mol电子即NA个,故D错误;
故选:AB.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
相关题目
7.下列化学用语正确的是( )
| A. | HSO3-+H2O?SO32-+OH- | B. | Al3++3H2O═3H++Al(OH)3↓ | ||
| C. | NaHCO3═Na++HCO3- | D. | H2S?2H++S2- |
4.下列各组物质,按照化合物、单质、混合物顺序排列的是( )
| A. | 干冰、铝粉、漂白粉 | B. | 生石灰、臭氧、熟石灰 | ||
| C. | 烧碱、液态氧、酒精 | D. | 铁红、晶体硅、胆矾 |
11.乙烯和苯是两种基本化工原料,下列有关说法正确的是( )
| A. | 乙烯和苯都可以从煤焦油中获得 | |
| B. | 乙烯和苯都是平面结构,因为二者分子中都含有碳碳双键 | |
| C. | 乙烯和苯都能使溴水褪色,且褪色的原因相同 | |
| D. | 乙烯和苯都能与H2发生加成反应 |
1.下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) | |
| B. | 20mL 0.1mol/L CH3COONa溶液与10mL 0.1mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) | |
| D. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
8.一定条件下,将1mol A和3mol B充入恒容密闭容器中,发生如下反应:A(g)+3B(g)?2C(s),下列不能说明该反应已经达到平衡状态的是( )
| A. | 气体的密度不再改变 | |
| B. | 混合气体中A的体积分数不再变化 | |
| C. | 混合气体的总压不再变化 | |
| D. | 单位时间内生成a mol A,同时生成2a mol C |
17.下列装置图中的实验方案能达到实验目的是( )
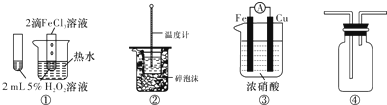

| A. | 图①可验证FeCl3对H2O2分解反应有催化作用 | |
| B. | 图②可用于中和热的测定 | |
| C. | 图③可用于探究铁作负极的原电池原理 | |
| D. | 图④可用于收集NH3 |